Tungsten [ˈvɔlfram] je chemický prvek se symbolem prvku W a pořadovým číslem 74. Je to jeden z přechodných kovů, v periodické tabulce je v 6. podskupině (skupina 6) nebo chromové skupině. Wolfram je lesklý bílý těžký kov s vysokou hustotou, který je v čistém stavu křehký. Ze všech čistých kovů má nejvyšší teplotu tání a druhou nejvyšší teplotu varu. Jeho nejznámějším použitím je tedy vlákno v žárovkách.
Již v 16. století popsal freibergský mineralóg Georgius Agricola výskyt minerálu v saských cínových rudách, což těžbu cínu značně ztížilo kvůli struskování obsahu cínu. Složka názvu „vlk“ pochází z této vlastnosti, protože minerál „požíral“ cínovou rudu jako vlk. Zda to byl wolframit, je dnes stále kontroverzní, když hovořil o „lehkosti“ minerálu. Pojmenoval minerál lupi spumumcož v překladu z latiny znamená „vlk (y) pěna“. Později se tomu říkalo Wolfram, z mhd. beran „Saze, špína“, protože černošedý minerál lze snadno rozdrtit a poté připomíná saze. Jeho chemický symbol W pochází z wolframu.
Společné slovo v angličtině, italštině a francouzštině Wolfram pochází z Tung Sten (Švédština pro „těžký kámen“). To neznamená, že samotný Wolfram (švédsky Volfram), ale nazývá se wolframan vápenatý. V roce 1781 v něm německo-švédský chemik Carl Wilhelm Scheele poznal dříve neznámou sůl. Čistý wolfram byl poprvé vyroben v roce 1783 španělskými bratry Faustem a Juanem José Elhuyarem (kteří pracovali pod Scheeleho vedením) redukcí oxidu wolframu, který se získává z wolframitu.
výskyt
Obsah wolframu v zemské kůře je kolem 0,0001 g / t neboli 0,0064 procenta hmotnosti (hodnota Clarke). Kov zatím nebylo možné v přírodě detekovat (v čisté formě). „Doklady Akademii Nauk“ v Rusku zveřejnila v roce 1995 zprávu o pevném wolframu, aniž by ji zkoumala „Komise pro nové minerály, nomenklaturu a klasifikaci“ IMA (CNMNC). Některé minerály, zejména oxidy a wolframany, jsou známé. Nejdůležitějšími wolframovými rudami jsou wolframit (Mn, Fe) WO4 a Scheelite CaWO4. Existují také další wolframové minerály, jako je Stolzit PbWO4 a Tuneptit WO3 · H2O.
Největší ložiska lze najít v Číně, Peru, USA, Koreji, Bolívii, Kazachstánu, Rusku, Rakousku a Portugalsku. Wolframové rudy najdete také v Krušných horách. Bezpečné a pravděpodobné světové zásoby představují v současné době 2,9 milionu tun čistého wolframu.
Nejvýznamnějším známým výskytem wolframu v Evropě je Felbertal ve Vysokých Taurech (spolková země Salcburk).
Propagace po celém světě
V roce 2006 činila světová produkce čistého wolframu 73.300 80 tun. Zdaleka největším producentem wolframu je Čína. Vyrábí se zde více než 2006% wolframu vyrobeného na světě. Státy s nejvyšší produkcí wolframu (XNUMX):
| Hodnost | Přistát | Dodací sazby (v tunách za rok) |
|---|---|---|
| 1 | Čína | 62.000 |
| 2 | Ruská Föd. | 4.500 |
| 3 | Kanada | 2.500 |
| 4 | Rakousko | 1.350 |
| 5 | Portugalsko | 900 |
| 6 | Severní Korea | 600 |
| 7 | Bolivien | 530 |
| 8 | dalších zemích | 900 |
Propagace v Rakousku
V Rakousku byl scheelit wolframové rudy poprvé objeven v letech 1815/16 na ložisku zlata Schellgaden v obci Muhr (stát Salcburk). Výsledkem bylo, že v mnoha štěrbinách Vysokých Taur byly nalezeny krásné krystaly scheelitu, někdy o velikosti několika centimetrů. Žádný z těchto nálezů neměl praktické využití. Velká záloha ve Felbertalu prozatím zůstala neobjevena.
V roce 1950 vyšlo najevo, že se velké množství scheelitu objevilo v ložisku magnezitu na Wanglalmu poblíž Lanersbach / Tux (Tyrolsko) v zadní části Zillertalu, který se těžil od roku 1927. Byl to hrubý scheelit porostlý magnezitem a křemenem. V následujících letech bylo vytěženo kolem 10.000 1,8 tun rudy s průměrným obsahem oxidu wolframu 1960%, což představuje světově unikátní kvalitu. Kvůli nízké tržní ceně byla těžba wolframu zastavena na konci 1971. let, ale obnovena byla v roce 1976 a pokračovala až do uzavření magnezitového dolu v roce XNUMX.
1967 byl nakonec objeven největší Scheelitvorkommen Evropa ve Felbertalu. Kusy rudy přítomné v proudech byly sledovány pomocí UV světla (Scheeliteovy fluorescenty). Náročné průzkumné práce ve vysokohorském terénu (nejvyšší hornické místo na Brentlingu v 2100 na hladině moře) začaly 1971, původně nadzemní těžba byla zaznamenána ve Felbertalu 1976 (od 1979 také podzemní těžba, povrchová těžba 1986). Od začátku 1993 do poloviny 1995 byla těžba dočasně pozastavena kvůli nízké tržní ceně wolframu.
Wolframová ruda z Felbertalu se zpracovává v nedalekém Mittersillu. Odtud se scheelitový koncentrát dostává do Sankt Martin im Sulmtal (Štýrsko). Na místě podzemního hnědouhelného dolu Pölfing-Bergla, který byl uzavřen v roce 1976, byla postavena huť wolframu, ve které se od roku 1977 z koncentrátů z několika zemí vyrábí oxid wolframu, kov wolframu a prášek z karbidu wolframu.
Nejdůležitějšími německými procesory jsou HC Starck a Longyear GmbH.
Extrakce a prezentace
Wolfram nelze získat z oxidických rud redukcí uhlím, protože to má za následek karbid wolframu.
Přidáním amoniakálního roztoku vznikne komplex zvaný amoniumparatungstát (APW). Ten se odfiltruje a poté převede na relativně čistý oxid wolframu při 600 ° C. Oxid wolframu (VI)3), který se při 800 ° C ve vodíkové atmosféře redukuje na ocelově šedý wolfram:
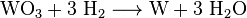
Tak vznikne šedý wolframový prášek, který se obvykle lisuje ve formách a elektricky slinuje do tyčí. Při teplotách nad 3400 XNUMX ° C lze kompaktní wolframový kov tavit ve speciálních elektrických pecích s redukční vodíkovou atmosférou (zónové tavení).
Eigenschaften
Fyzikální vlastnosti
Wolfram je lesklý bílý kov, který lze napnout v čistém stavu a má vysokou tvrdost, hustotu a pevnost. Hustota je téměř stejná jako u zlata, tvrdost podle Brinella 250 HB, pevnost v tahu 550-620 N / mm2 (měkký) až 1920 N / mm2 (tvrdý). Kov existuje ve stabilní kubické α-modifikaci zaměřené na tělo s roztečí mřížkové roviny (= mřížková konstanta) 316 pm při teplotě místnosti. Tento typ krystalové struktury se často nazývá wolframový typ. S as metastabilní β-modifikace wolframu (zdeformovaný na kubický organismus), na druhé straně je to oxid wolframu bohatý na W3O.
Po prvku uhlík má wolfram druhou nejvyšší teplotu tání ze všech chemických prvků při 3422 ° C. Bod varu 5555 ° C překročí rhenium vzácných kovů s 5596 ° C pouze o 41 K.
Kov je supravodič s přechodovou teplotou 15 mK.
Chemické vlastnosti
Wolfram je chemicky velmi odolný kov, který je těžko napadnut i kyselinou fluorovodíkovou a aqua regia (alespoň při pokojové teplotě). Rozpouští se však ve směsích kyseliny fluorovodíkové a dusičné a v roztavených směsích dusičnanů a uhličitanů alkalických kovů.
izotop
Z wolframu je známo 33 izotopů a 5 jaderných izomerů. Z nich se v přírodě vyskytuje 5 izotopů 180W, 182W, 183W, 184W a 186W. Izotop wolframu 184W má největší frekvenci. Všech 5 přírodních izotopů bylo po dlouhou dobu považováno za stabilní. Teprve v roce 2004 se experimentu CRESST na Laboratori nazionali del Gran Sasso podařilo dokázat, že izotop byl sekundárním výsledkem hledání temné hmoty 180W podléhá rozkladu alfa. Poločas je extrémně dlouhý 1,8 bilionu let, takže tento rozpad nelze detekovat v normálním laboratorním prostředí. Radioaktivita tohoto přírodního izotopu je tak nízká, že může být ignorována pro všechny praktické účely. Naproti tomu umělé radioaktivní izotopy wolframu mají krátký poločas mezi 0,9 ms 185W a 121,2 dní v 181W.
Verwendung
Nejdůležitější aplikací wolframu je kvůli jeho vysokému bodu tání v osvětlovacím průmyslu jako vlákno ve žárovkách a jako elektroda v plynových výbojkách a elektronkách.
U žárovek se využívá skutečnosti, že elektrická vodivost wolframu je výrazně nižší než u vodivých kovů mědi a hliníku. Výsledkem je, že se tenké wolframové vlákno zahřívá, dokud nesvítí, zatímco silnější vodiče vyrobené z vodivých kovů se jen těžko zahřívají.
Má druhý velký význam jako slitinový kov v metalurgii železa. Vytváří karbidy wolframu v nástrojových ocelích, což zvyšuje sekundární tvrdost.
Díky své vysoké hustotě se používá pro vyvažovací závaží a pro stínění proti záření. Ačkoli je jeho hustota, a tedy i stínící účinek, mnohem vyšší než hustota olova, používá se pro tento účel méně často než olovo, protože je nákladnější a obtížněji zpracovatelný. Kvůli vysoké hustotě wolframu také některé armády místo levnějšího, ale radioaktivního a toxického ochuzeného uranu používají průbojnou munici s jádrem střely vyrobeným z karbidu wolframu. Během druhé světové války byl wolfram důležitý pro stavbu německého tankového granátu 40, který měl wolframové jádro. V budoucnu bude munice s wolframovým jádrem použita v novém bojovém vozidle pěchoty Puma, které má nahradit Marder.
Díky vysoké odolnosti vůči korozi lze wolfram použít také jako materiál pro zařízení v chemických provozech. Avšak kvůli špatné obrobitelnosti wolframu (wolfram může být svařován pouze laserovým nebo elektronovým paprskem) je toto provedení používáno jen zřídka. Totéž platí pro myslitelné použití v oblasti lékařské techniky.
Ve fyziologii, zejména v neurofyziologii, se wolframové mikroelektrody používají pro extracelulární záznamy.
Kromě toho jsou elektrody pro svařovací procesy vyráběny z wolframu. Například při odporovém svařování, zejména při svařování materiálů jako je měď, bronz nebo mosaz. Také při univerzálním svařování TIG (wolframový inertní plyn) je elektroda vyrobena z wolframu nebo jeho slitiny. Během svařování se tyto elektrody neroztavují. Oblouk hoří jako plazma v ochranném plynu mezi elektrodou a součástí. Výplňový materiál je dodáván samostatně ve formě tyčí.
Ve sportu se wolfram používá k výrobě vysoce kvalitních sudů pro šipky, v lukostřelbě se používají k výrobě špiček pro speciální šípy a hlavy kladiv se někdy vyrábějí z wolframu, aby se snížil odpor vzduchu a poloměr otáčení při házení kladivem. Kromě toho se wolframové desky ve Formule 1 používají jako přídavná závaží, aby se dosáhlo předepsané minimální hmotnosti vozů Formule 1 (včetně oleje, brzd a chladicí kapaliny, jakož i řidičů v závodních kombinézách a s přilbou) 620 kg (od roku 2010). To bylo také používáno velkými závodníky v kýlových bombách při plavbě na nějakou dobu. Odolnost proti vodě je výrazně snížena díky vyšší hustotě ve srovnání s běžnými materiály, jako je olovo nebo litina. K dispozici jsou také tenisové rakety, které mají do rámu z uhlíkových vláken zabudovaná wolframová vlákna. Tímto způsobem mohou být dodatečně stabilizovány specifické oblasti rámu rakety, aby se zvýšila přesnost hraní.
Při muškaření jsou nymfy a fáborky (návnady lovené pod vodou) zatěžovány wolframovými korálky, které jsou propíchnuty a tlačeny na dřík háku, aby se potápěly rychleji a hlouběji.
Struny pro hudební nástroje jsou někdy navinuty wolframem, aby se zvýšila jejich hmotnost a tím se snížila výška tónu.
Wolfram se také používá v rentgenové diagnostice jako cílový materiál v anodě. The 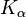 - a
- a 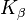 - Čáry charakteristického rentgenového záření jsou kolem 59 keV a 67 keV.
- Čáry charakteristického rentgenového záření jsou kolem 59 keV a 67 keV.
Ve skenovací tunelové mikroskopii se wolfram často používá jako materiál pro hrot sondy.
Od začátku 21. století se karbid wolframu, nesprávně označovaný jako wolfram, používá také v klenotnictví (wolframové šperky), např. B. kroužky zpracovány. To je velmi snadné určit z tvrdosti a hustoty. WC má tvrdost podle Mohse 9,5, wolfram pouze 7,5. Všechny šperky na trhu byly dosud vyrobeny z karbidu wolframu.
fyziologie
Wolfram je anaerobními bakteriemi tohoto typu považován za pozitivní biologický prvek Eubacterium acidaminophilum použitý a začleněný jako kofaktor v některých enzymech. E. acidaminophilum je bakterie fermentující aminokyseliny, která používá wolfram v enzymech formate dehydrogenase a aldehyde dehydrogenase. V těchto organismech wolfram nahrazuje molybden, protože je mnohem běžnější v jejich přirozeném prostředí (sopečné otvory na mořském dně).
toxikologie
Podle současného stavu znalostí jsou wolfram a jeho sloučeniny považovány za fyziologicky neškodné. Rakovina plic u pracovníků v závodech na výrobu nebo zpracování tvrdých kovů je přičítána kobaltu, který je také přítomen.
Na zvířecím modelu bylo zjištěno, že největší množství orálně požitých sloučenin wolframu se rychle vylučuje močí. Malá část wolframu jde do krevní plazmy a odtud do erytrocytů. Poté se ukládá v ledvinách a v kostním systému. Tři měsíce po podání se většina velmi malého množství wolframu absorbovaného tělem nachází v kostech.
V roce 2003 byly ve Fallonu / Nevadě se 16 dětmi trpícími leukémií od roku 1997 a v Sierra Vista / Arizona s devíti dětmi trpícími také rakovinou krve, identifikovány dva takzvané klastry rakoviny - jedná se o místní oblast s nadprůměrným výskytem rakovinových onemocnění. Na obou místech má pitná voda výjimečně vysoké koncentrace wolframu. V moči široké veřejnosti byly zjištěny významně zvýšené koncentrace wolframu. Obě místa jsou známá svými ložisky wolframové rudy. V následných vyšetřováních Centra pro kontrolu nemocí (CDC), která trvala přibližně rok, nebylo možné navázat přímé spojení mezi wolframem a leukémií. Wolfram nevykazoval žádné karcinogenní účinky u žádné testovací metody a na jiných místech Nevady nebyly nalezeny žádné shluky rakoviny s podobně vysokými hodnotami wolframu v moči populace.
bezpečnost
Jako prášek nebo prach je snadno hořlavý, nehořlavý v kompaktní formě.
Připojení
oxid
Wolfram tvoří několik oxidů. Mezi počátečním členem:
- Oxid wolframový (WO) WO3 - citronově žlutá
a konečný člen:
- Oxid wolframový WO2 - hnědá
Existují nějaké další meziprodukty?
- W10O29 modro-fialové, rozmezí homogenity WO2,92Kde2,88
- W4O11 červeno-fialové, rozmezí homogenity WO2,76Kde2,73
- W18O49, KDE2,72
- W20O50, KDE2,50
Ostatní sloučeniny
- Wolframan sodný Na2WO4
- Wolframan zirkoničitý ZrW2O8 vykazuje anomálii při zahřátí.
- Wolframové bronzy MxWO3; M = alkalický kov, kov alkalických zemin, lanthanoid, přibližně 0.3 <x <0.9 mají elektrickou vodivost a jsou intenzivní a různě zabarvené v závislosti na obsahu kovů.
- Wolframan vápenatý CaWO4 je známý jako minerál pod názvem Scheelite.
- Tungsten Carbide WC je směs extrémně tvrdého kovu. Nechybí ani Diwungsten Carbide W2C.
- Hexafluorid wolframu WF6
- Olovo wolframan PbWO4
- Wolfram disulfid WS2 Používejte jako suché mazivo (podobné MoS2)
Použití sloučenin
Karbid wolframu se používá jako neutronový reflektor v jaderných zbraních ke snížení kritického množství. Karbidy wolframu (tvrdé kovy) se používají při zpracování materiálu kvůli své vysoké tvrdosti.
Wolframy se používají k impregnaci tkanin, aby byly nehořlavé.
Wolframové barvy se používají v malířství i v keramickém a porcelánovém průmyslu.
Wolframan olovnatý se používá jako moderní scintilátor ve fyzice částic.
| Obvykle | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Jméno, symbol, atomové číslo | Wolfram, W, 74 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie | Přechodné kovy | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupina, období, blok | 6, 6, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| vzhled | šedavě bílá, lesklá | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| číslo CAS | 7440-33-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hmotnostní zlomek zemského pláště | 64 ppm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| jaderný | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| atomová hmotnost | 183,84 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomový poloměr (vypočítaný) | 135 (193) hodin | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalentní poloměr | 162 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| elektronová konfigurace | [Xe] 4f145d46s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. ionizace | 770 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. ionizace | 1700 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| fyzicky | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| fyzický stav | fest | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| krystalová struktura | kubický na střed těla | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| hustota | 19,3 g / cm3 (20 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| tvrdost Mohs | 7,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| magnetismus | paramagnetické ( = 7,8 10-5) = 7,8 10-5) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| bod tání | 3695 K (3422 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| bod varu | 5828 K (5555 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molární objem | 9,47 · 10-6 m3/ mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Výparné teplo | 824 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| skupenské teplo tání | 35,4 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rychlost zvuku | 5174 m / s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Měrná tepelná kapacita | 138 J / (kg · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrická vodivost | 18,52 · 106 A / (V · m) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| tepelná vodivost | 170 W / (m K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| chemický | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| oxidační stavy | 6, 5, 4, 3, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| normální potenciál | -0,119 V (WO2 + 4H+ + 4e- → W + 2H2O) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| electronegativity | 2,36 (Paulingova stupnice) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| izotop | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| vlastnosti NMR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| bezpečnost | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
Fráze H a P H: 228EUH: žádné sazby EUHP: 210-240-241-280-370+378 Gefahrstoffkennzeichnung
 |
| lehká váha hořlavý |
| (F) |
Práškové R- a S-věty R: 11S: 43

