Tellurium, Te, atomové číslo 52
Cena teluria, výskyt, těžba a použití
Tellurium [tʰɛluːɐ̯] (latinský tellus "earth") je vzácný chemický prvek se symbolem prvku Te a atomovým číslem 52. V periodické tabulce je v šesté hlavní skupině, nebo 16. IUPAC Group a 5. Období a je jedním z Chalkogens. Jeho frekvence je podobná frekvenci zlata, se kterým také vstupuje do různých sloučenin, které se vyskytují v přírodě jako minerály. Krystalický telur je stříbro-bílý lesklý kovový polokov, který se podobá cínu a antimonu. Reaguje křehce na mechanické namáhání, a proto jej lze snadno rozmělnit. V chemických sloučeninách s nekovy je svým chováním blízká síra a selen, ve slitinách a intermetalických sloučeninách, ale vykazuje velmi výrazné (polo) kovové vlastnosti.
Historie
Tellurium byl 1782 rakouským chemikem a mineralogem Franzem Josefem Muellerem z Reichensteinu (1740-1825) při vyšetřování zlatých rud z dolu Mariahilf na hoře Faczebaja ve Zlatně (německý Klein Schlatten, Zalatna) poblíž Sibiu (německý Hermannstadt) (Sedmihradsko, Rumunsko), což přineslo méně zlata, než se očekávalo. O rudách se dozvěděl vědeckým pojednáním Ignaze von Born (1742-1791) o skvrnitém Spiesglaskönigu v Sedmihradsku. Spiesglaskönig označuje pevné antimon, Spiesovo sklo je staré jméno pro minerální antimonit (Stibnit, Grauss casting Sb2S3). Von Born držel pevný kov ve zlaté rudě pro antimon a připsal nízký výnos kombinaci zlata s antimonem. Mueller von Reichenstein byl v rozporu s tímto názorem a považoval jej za první pro „sířený bizmut“. Po dalším zkoumání, jehož výsledky publikoval mezi 1783 a 1785 ve čtyřdílné eseji, ale vyloučil také bizmut, protože kov na rozdíl od antimonu a bizmutu prakticky nereagoval s kyselinou sírovou. On dal kovové fázi jméno metallum problematicum (také aurum problematicum nebo aurum paradoxum). Podle současných znalostí existuje vedle pevného teluria minerálů Nagyágit (listy rudy, AuPb (Pb, Sb, Bi) Te2-3S6) a Sylvanite (písmo, (Au, Ag) Te2). Mueller von Reichenstein navrhl, že metallum problematicum „... možná nový, dosud neuznaný polokov,“ chtěl, aby jeho nálezy potvrdil pouze švédský mineralog a chemik Torben Olof Bergman (1735-1784). V roce 1783 poslal vzorky rudy do Bergmanu ke kontrole, ale nedostal definitivní odpovědi. Bergman zemřel 1784 a vyšetřování metallum problematicum byla prozatím přerušena.
Až o dvanáct let později, v roce 1797, dostal Martin Heinrich Klaproth (1743-1817) vzorky rud od Müllera von Reichensteina v Berlíně. Klaproth potvrdil závěry vyšetřování Müllera von Reichensteina a viděl dostatek důkazů pro objev nového prvku. V lednu 1798 Klaproth na přednášce ocenil zásluhy Müllera von Reichenstein a připsal mu objev nového prvku. Protože Mueller von Reichenstein dal elementu žádné jméno, Klaproth se rozhodl pro jméno Tellurium (latinsky tellus: "earth"):
Abych zaplnil tuto mezeru v chemické mineralogii, předkládám zde své experimenty a zkušenosti s těmito drahými rudami, jejichž hlavním výsledkem je objev a validace nového zvláštního kovu, ke kterému přidávám jméno Tellurium vypůjčené ze staré Matky Země. "
Originální násadce ukázkového materiálu typu lokality Zlatna, který měl Klaproth k dispozici, jsou dnes v přírodovědném muzeu v Berlíně.
Nezávisle na Müllerovi von Reichenstein a Klaproth, 1789 objevil maďarského lékárníka a botanika Paula Kitaibela (1757-1817) tellurium při vyšetřování zlaté rudy z těžební vesnice Nagybörzsöny (Deutsch-Pilsen) v Maďarsku. Klaproth se ve své publikované přednášce zmínil pouze o Müllerovi von Reichensteinovi, i když si od 1796 od rukopisu Kitaibelse také vědom jeho vyšetřování. V dopise Kitaibelovi Klaproth prohlásil, že ztratil obsah rukopisu a že při vyšetřování rudy Müller von Reichenstein neviděl žádnou souvislost s jeho prací. Nakonec Klaproth konečně přesvědčil Kitaibela, že objev teluria by měl být přičítán pouze Muellerovi von Reichensteinovi, protože před několika lety učinil stejná pozorování k novému prvku.
Symbol prvku „Te“ navrhl 1814 Jöns Jakob Berzelius (1779-1848) a používá se dodnes. Prvním objasněním struktury krystalického teluru s rentgenovou difrakcí bylo 1924.
výskyt
Tellurium je vzácný prvek; jeho příspěvek k zemské kůře je asi 0,01 ppm (g / t). Se zlatem, podřízeným stříbru, mědi, olovu a bizmutu, jakož i platinovým kovům, se vzácně vyskytuje důstojně, tj. V elementární formě v přírodě.
Pevné telurium patří jako minerál do skupiny prvků, přesněji do polotovarů a nekovů a patří do klasifikace minerálů podle Strunze pod číslem I / B.03-40 (vydání 8) nebo 1.CC.10 (9). Edition) a vedl k Daně pod číslem 1.3.4.2.
V pevném teluru (selen) mohou být obsaženy stopy po větším množství selenu. Ačkoli telur je vzácný prvek, je známo relativně velké množství minerálů, protože telur tvoří vlastní minerály, protože je málokdy začleněn do sulfidů nebo selenidů nebo sulfátů nebo selenátů; to je příliš velké pro tyto krystalové mřížky lehčích homologů. Naopak, dva lehčí homology častěji představují telurium na jeho mřížových místech v krystalové struktuře minerálů obsahujících telur.
Tellurium vykazuje nejvyšší afinitu ke zlatu ze všech prvků, a proto se v přírodě často vyskytuje ve formě telluridů zlata, minerálů s telluridem (Te2) nebo ditelluridových aniontů (Te22-). Kromě zlata a jiných drahých kovů tvoří olovo a bizmut přirozenější teluridy, často doprovázející (paragenesiany) důstojné kovy a zlaté rudy.
Vzácnější jsou minerály s kationty Te4 + v krystalové struktuře, přičemž nejdůležitější oxid teluria, oxid telurnatý TeO2, se vyskytuje ve dvou modifikacích jako ortorombický telurit a tetragonální paratellurit v přírodě. Dalšími kationty teluria (IV) jsou oxotelluráty (IV) (telurity) obsahující komplexní anionty [TeO3] 2 nebo [TeO4] 4. Minerály obsahující kationty Te6 + ve formě oktaedrálních [TeO6] komplexních aniontů 6 jsou extrémně vzácné, přičemž minerály 21 většinou obsahují měď a olovo. Kromě zmíněných minerálů existují v přírodě také smíšené valenční telluriové minerály, včetně oxo-telurátu vápenatého (IV, VI) Carlfriesite CaTe3O8 s Te4 +: Te6 + poměr 2: 1. [14] [15] pro minerály + TeXNUM + +XUMUM Kationty jsou sekundární minerály, které vznikly z povětrnosti telluru a telluridu.
Minerály s obsahem telurů nejsou pro technickou výrobu telurů důležité, protože jsou vzácné a prakticky neexistuje žádná ložiska, která by stála za těžbu. Kromě typové lokality Zlatna (Transylvánie, Rumunsko) patří mezi známé minerály bohaté na tellurium také Moctezuma (Mexiko), Cripple Creek (Colorado), Kalgoorlie (Austrálie) a Calaveras (Kalifornie). Dosud (jako v případě 2012) jsou minerály obsahující telurium 154 známé, z nichž však pět (dilithium, imgreit, kurilite, sztrokayite, protojoseite) dosud nebyly Mezinárodním mineralogickým sdružením (IMA) uznány nebo zdiskreditovány jako nezávislé minerály.
Extrakce a prezentace
Tellurium spolu se selenem se průmyslově získávají výhradně z vedlejších produktů výroby elektrolytické mědi a niklu ve velkém měřítku. Výsledné anodové kaly obsahují ve vodě nerozpustné telluridy a -selenidy obecného vzorce M2Ch (M = Cu, Ag, Au, Ch = Se, Te), které při teplotách vyšších než 500 ° C pod atmosférickým kyslíkem (O2) s sodíkem (uhličitan sodný Na2CO3) ). Kationty vzácných kovů (M +) se tím redukují na elementární kovy (M), které oxidují teluridové anionty na oxo-teluráty (IV) (TeO32-):
Alternativně lze tuto reakci provést také s kyselinou dusičnou (dusičnan sodný NaNO3) v nepřítomnosti vzduchu a tvorbou oxidů dusíku (NO a NO2):
Výsledný telurát sodný (IV) Na2TeO3 se poté rozpustí ve vodě, kde zásaditě reaguje a tvoří ionty hydrogentellurátu (HT) HTeO3-. Oddělení telurátů (IV) od podobně vytvořených selenátů (IV) v zásaditém roztoku neutralizací přidáním kyseliny sírové (H2SO4), která se vysráží ve vodě téměř nerozpustný oxid teluričitý TeO2:
Oxid telluričitý může být redukován na elementární telur v louhech elektrolýzou nebo chemickými prostředky rozpuštěním v koncentrovaných minerálních kyselinách a zavedením oxidu siřičitého SO2, přičemž síra je tvořena z molekul SO2 (nebo z nich se v roztoku vytvářejí sirníkové ionty SOxnumx). ) a síranové ionty (SO32-) se tvoří:
Proces zónového tavení se používá k získání vysoce čistého teluru (> 99,9%).
Globální roční produkce teluria vzrostla z 298 tun v 2013 o 53% na 457 tun v roce 2017, průměrně 382,8 tun za rok (t / a). Mezi hlavní producenty patří Čína (∅ 220,0 t / a), USA (∅ 50,0 t / a), Rusko (∅ 35,6 t / a), Švédsko (∅ 32,4 t / a), Japonsko (∅ 31,8 t / a) a Kanada (∅ 13,0 t / a). Přehled produkčních množství jednotlivých zemí je uveden v tabulce. Jiné průmyslové země, jako je Německo a Belgie, pravděpodobně produkují telur, ale nejsou k dispozici žádné údaje. [17] Geologický průzkum Spojených států (USGS) odhaduje globální zásoby teluria v 2019 na přibližně 31.000 tun.
| Přistát | 2013 | 2014 | 2015 | 2016 | 2017 | ∅ |
|---|---|---|---|---|---|---|
| Čína | 150 | 180 | 210 | 279 | 281 | 220,0 |
| Spojené státy americké | 50 | 50 | 50 | 50 | 50 | 50,0 |
| Rusko | 31 | 33 | 34 | 40 | 40 | 35,6 |
| Schweden | 24 | 31 | 33 | 39 | 35 | 32,4 |
| Japonsko | 31 | 32 | 34 | 28 | 34 | 31,8 |
| Kanada | 12 | 9 | 9 | 18 | 17 | 13,0 |
| hučení | 298 | 335 | 370 | 454 | 457 | 382,8 |
 |
||||||
modifikace
Krystalický telur
Za standardních podmínek je známa pouze krystalická modifikace (Te-I nebo a-Te) telluru, která se označuje jako krystalická nebo kovová tellura. Je izotypický pro α-selen, to znamená, že má stejnou krystalovou strukturu. V trigonálním krystalovém systému ve vesmírné skupině P3121 (č. 152) krystalizuje telurium s parametry mřížky a = 446 pm a c = 592 pm a třemi jednotkami vzorce v jednotkové buňce (nejmenší jednotka krystalové struktury).
Vesmírná skupina P3121 (č. 152), popsaná podle symboliky Hermanna Mauguina, vysvětluje centrování jednotkové buňky a existujících prvků symetrie. P znamená, že mříž Bravais je primitivní. Za informací o centrování následují existující prvky symetrie vesmírné skupiny: 31 popisuje trojnásobnou osu šroubu (násobení částice rotací o 120 ° a posunutí (posunutí) o 1/3 ve směru osy rotace) rovnoběžně s krystalografickou osou c ([001]) ), 2 popisuje dvojitou osu rotace (násobení rotací o 180 °) rovnoběžnou se třemi krystalografickými osami a (<100>), 1 prvek symetrie jediné osy symetrie nebo identity (násobení rotací o 360 °, takže se tvoří částice na sebe) ve směru kolmém na osy a a osu c (<120>).
Krystalová struktura obsahuje pouze jeden krystalograficky rozlišitelný atom telurů s pozicními souřadnicemi x = 0,2636, y = 0 a z = 1 / 3. Všechny ostatní atomy krystalové struktury lze tomuto atomu přiřadit pomocí existujících prvků symetrie prostorové skupiny. Jelikož se atom teluru shoduje ve své poloze s dvojnásobnou osou symetrie prostorové skupiny (P3121 (č. 152)), je násoben výhradně osou trojnásobného šroubu (31). To vede k spirálovitým řetězcům kovalentně vázaných atomů telurů rovnoběžných s osou c. Atomy teluru jsou uvnitř řetězce 284 pm od sebe, úhel vazby je 103,1 °. Odkazy v řetězci jsou na obrázcích zvýrazněny červeně, jeden řetězec je zobrazen modře pro přehlednost, s tmavě modrým atomem na z = 1 / 3, prostřední modrou na z = 2 / 3 a světle modrou na z = 1 nebo z = 0 je umístěn. Každý třetí atom v řetězci je proto shodný. Každý řetěz je obklopen šesti dalšími řetězci. Van der Waalsovy vazby existují mezi řetězci s Te-Te vzdálenostmi 349 pm (zobrazeny zelenými přerušovanými čarami), které jsou výsledkem pádu pod van der Waalsův poloměr (2 · 206 pm = 412 pm) atomů telurů , Výsledkem jediného atomu teluru je koordinační číslo 6, přesněji 2 + 4, protože atomy 2 pocházejí ze stejného řetězce a mají tedy menší vzdálenost než ostatní 4 od sousedních řetězců. Jako koordinační polyhedron má za následek zkreslený osmiúhelník (zvýrazněný žlutě).
Tellurium může také krystalizovat ve vesmírné skupině P3221 (# 154) místo P3121 (# 152). Osa šroubu 32 také duplikuje atom otáčením kolem 120 °, ale poté jej posune o 2 / 3 místo 1 / 3 ve směru osy otáčení. Tím se také vytvoří spirálové řetězy, které se otáčejí ve směru hodinových ručiček, nikoli proti směru hodinových ručiček (v ose šroubu 31) podél osy c. Krystalová struktura ve vesmírné skupině P3221 (č. 154) („vlevo“) je tedy zrcadlovým obrazem struktury ve vesmírné skupině P3121 (č. 152) („právní forma“). Vzhled krystalických forem zrcadlového obrazu se v krystalografii nazývá enantiomorfismus.
Tellurium krystalický systém je často označován jako hexagonální. Hexagonální a trigonální krystalický systém je založen na stejné jednotkové buňce, ale hexagonální symetrie by vyžadovala přítomnost šestinásobné osy symetrie (6, násobení částice rotací kolem 60 °). Krystalová struktura teluru však obsahuje pouze trojnásobnou osu šroubu (31) a patří tedy nepochybně do dolního symetrického trigonálního krystalového systému.
Při vysokotlakých experimentech s krystalickým tellurem (Te-I nebo a-tellurium) byly objeveny další modifikace. Stanovené tlakové rozsahy pro stabilitu úprav se v literatuře částečně liší:
- Te-II krystalizuje v monoklinickém krystalovém systému v rozsahu tlaku od 4 do 6,6 GPa. C2 / m (č. 12) a P21 (č. 4) jsou v literatuře uvedeny jako možné prostorové skupiny.
- Te-III krystalizuje v ortorombickém krystalovém systému a je stabilní v tlakovém rozmezí nad 6,6 GPa. Pro ortorombickou modifikaci existuje teoretický výpočet ve vesmírné skupině Imma (č. 74).
- Te-IV krystalizuje v trigonálním krystalovém systému ve vesmírné skupině R3m (č. 166) a odpovídá struktuře β-polonia. Je stabilní v rozsahu tlaku od 10,6 do 27 GPa. Vzdálenosti atomů teluru v řetězcích a sousedních řetězcích v této modifikaci jsou stejné a každá činí 300 pm, což má za následek vyšší symetrii ve srovnání s a-Te.
- Te-V je stabilní nad 27 GPa. Pro tuto modifikaci se předpokládá mřížka na střed kubického těla (prostorová skupina Im3m (# 229)).
Amorfní telur
Nestabilní amorfní modifikace je hnědý prášek a může být připraven z kyseliny telurové (H2TeO3) reakcí s kyselinou sírovou (H2SO3) nebo siřičitanovými ionty (SO32-). Sulfitové ionty se tím oxidují na síranové ionty (SO42-), zatímco kationty Te4 + se redukují na elementární telur:
Amorfní telurium se za standardních podmínek pomalu přeměňuje na krystalickou modifikaci.
Fyzikální vlastnosti
Krystalický telur je vlastní přímý polovodič s pásmovou mezerou 0,334 eV. Stejně jako u všech polovodičů lze elektrickou vodivost zvýšit zvýšením teploty nebo expozice, ale to vede pouze k mírnému zvýšení obsahu teluria. Elektrická vodivost a tepelná vodivost se chovají směrově v závislosti na telluru, to je anizotrop. Krystalický telur je měkký (Mohs 2,25) a křehký materiál, který se snadno zpracovává na prášek. Zvýšením tlaku se telur přemění na další krystalické modifikace. Při teplotě nad 450 ° C prochází telur do červené taveniny a při teplotách nad 990 ° C je telur přítomen jako žlutý diamagnetický plyn molekul Te2. Při teplotách nad 2000 ° C se molekuly Te2 rozkládají na jednotlivé atomy.
Chemické vlastnosti
Krystalický telur je nerozpustný ve vodě a špatně rozpustný v minerálních kyselinách, kyselině chlorovodíkové a kyselině sírové a zásadách. Na druhé straně je velmi rozpustný v kyselině dusičné, protože je to velmi silné oxidační činidlo a oxiduje elementární telur na teluráty se stabilním oxidačním stavem + IV. Tellurium taje zaútočit na měď, železo a nerezovou ocel.
Ve sloučeninách s nekovy se tellurium chová jako selen v lehčím členu skupiny. Ve vzduchu hoří zeleně lemovaným modrým plamenem na oxid telluričitý TeO2:
Tellurium spontánně reaguje s halogeny za vzniku halogenidů telluria. Je pozoruhodné, že na rozdíl od lehčích homologů selen a síra, tellur také tvoří termodynamicky stabilní jodidy, včetně teluriumjodidu TeI s oxidačním stavem + I. Se základními kovy, jako je zinek, prudce reaguje na odpovídající telluridy.
izotop
Tellurium je známé pro masově číslované izotopy mezi 105 a 142. Přirozené tellurium je smíšený prvek sestávající z osmi izotopů, z nichž pět (122Te, 123Te, 124Te, 125Te, 126Te) je stabilní. Izotop 123Te by se měl teoreticky rozkládat na 123Sb při elektronovém záchytu. Tento úpadek však dosud nebyl pozorován; spodní limit pro jeho poločas rozpadu je 9,2 · 1016 let (92 quadrillion years). Izotop 120Te přechází přímo do 120Sn pomocí dvojitého elektronového záchytu. Izotopy 128Te a 130Te se převádějí na 128Xe a 130Xe emisemi beta záření (dvojitý beta rozpad).
Hlavním přispěvatelem do přírodního teluria je přibližně jedna třetina izotopu 130Te s poločasem 7,9 · 1020 let, následovaný izotopem 128Te. Průměrná atomová hmotnost přirozených izotopů telurů je proto 127,60, která je větší než hmotnost jódu čistého prvku, přičemž 126,90 sleduje v periodické tabulce. 128Te je považován za izotop s nejpomalejším rozpadem všech nestabilních izotopů všech prvků. Extrémně pomalý rozpad s poločasem 7,2 · 1024 let (7 quadrillion years, tj. V 1 kilogramech se jeden atom rozpadne každých 18 měsíců) lze zjistit pouze detekcí produktu rozpadu (128Xe) ve velmi starých vzorcích přírodního teluria.
Z ostatních izotopů má jaderný izomer 121mTe nejdelší poločas s 154 dny. Rovněž pro izotopy 127Te a 129Te jsou poločasy izomerů nad poločasy v základním stavu. Nejběžněji používaným indikátorem je izotop 127Te, následovaný 121Te. Izotopy 127Te a 129Te se také vyskytují jako štěpné produkty v jaderném štěpení v jaderných reaktorech.
Verwendung
Tellur je technicky méně důležitý prvek, protože jeho výroba je nákladná a jiné prvky nebo sloučeniny jsou při použití často ekvivalentní. V roce 2016 bylo prokázáno elementární, polykrystalické a dotované telurové termoelektrické chování s vysokou hodnotou zásluh v rozmezí mezi pokojovou teplotou a 400 ° C. Elementární telur se používá v kovozpracujícím průmyslu jako přísada (<1%) do oceli, litiny, mědi a slitin olova a do nerezových ocelí. Podporuje odolnost proti korozi a zlepšuje mechanické vlastnosti a obrobitelnost. Čistý telur se doposud jako polovodič používal jen zřídka; telur se většinou používá ve sloučeninových polovodičích II-VI. Tellurid kademnatý CdTe je z. B. používané ve fotodiodách a tenkovrstvých solárních článcích k výrobě elektřiny ze světla.
Bismuth telluride Bi2Te3 se používá v termočláncích k výrobě elektřiny v termoelektrických generátorech (např. V radionuklidových bateriích) nebo v Peltierových prvcích pro chlazení.
Kombinace germania GeTe a antimonového telluridu Sb2Te3 se používají v materiálech s fázovou změnou jako součást optických paměťových disků (např. CD-RW) nebo v nových paměťových materiálech, jako je paměť s náhodným přístupem k fázovým změnám.
Vzhledem k jejich vysokým indexům lomu se v optických vlnovodech používají místo oxidu siřičitého SiO2 skleněné dioptrické brýle TeO2.
V mikrobiologii se jako selektivní živné médium pro detekci stafylokoků a Corynebacterium diphtheriae používá bezbarvý tellurát draselný (IV) K2TeO3. Bakteriální kolonie se jeví jako malé černé koule, protože redukují kationty Te4 + na elementární telur a ukládají je do svých buněk.
Tellurium (nebo telurát draselný) poprvé použil 1890 k léčbě nočního pocení u pacientů s tuberkulózou.
Kromě toho se malé množství teluru používá pro vulkanizaci kaučuku, v rozbuškách a pro barvení skla a keramiky. Soli teluria se částečně používají k výrobě trávy zelené barvy v ohňostrojích.
Bezpečnostní pokyny a toxicita
V rozpustné formě je telur pro lidský organismus jedovatým prvkem, a proto byl v minulosti klasifikován jako jedovatý. Jelikož je však elementární telur velmi špatně rozpustný ve vodě a vlastních kyselinách v těle, byl degradován na škodlivý. Studie Nizozemské organizace pro aplikovaný vědecký výzkum (TNO) ukázaly, že hodnota LD50 (orální) u potkanů je> 5000 83 mg / kg. Hodnota 1982 mg / kg uvedená v mnoha bezpečnostních listech z knihy Toxicometric Parameters of Industrial Toxic Chemicals under single Exposure od NF Ismerow, která pochází z roku 26 [50], platí pouze pro snadno rozpustné sloučeniny telluru. Přesto různí výrobci nadále používají starou hodnotu LD301 pro elementární telur (prášek) a toxickou klasifikaci v souvislosti s H-větou XNUMX („Toxický při požití“).
Tellurium není tak toxické jako selen. To je analogické sousedním prvkům 5. Hlavní skupina, kde antimon je také méně toxický než arsen. Pokud je telur, zejména ve formě snadno rozpustných sloučenin teluria, jako jsou teluráty alkalických kovů (např. Na2TeO3) po požití (perorální) v těle, vytvořen redukcí toxického dimethyltelluridu (Me2Te: H3C-Te-CH3), který způsobuje poškození krve, jater Může způsobit srdce a ledviny. Protože snadno rozpustné sloučeniny teluru uvolňují daleko více teluru, jsou také klasifikovány jako nebezpečnější. Otrava telurem se projevuje intenzivním česnekovým zápachem prodyšného vzduchu, který je způsoben dimethyltelluridem, nejprve Christianem Gottlobem Gmelinem, 1824em (za jeho vůbec první studie o vlivu teluria na živé věci). Bude to trvat několik týdnů, než se vyvíjí a vyvíjí i na velmi nízkých hladinách, které nezpůsobují vážné otravy. Tuto vůni česneku na rozdíl od skutečného česneku nelze odstranit kartáčkem na zuby. Usadí se také v místnosti a odjede až po několika hodinách. Rovněž se pomalu vylučuje kůží.
Tellurstovy prachy se mohou ve vzduchu spontánně vznítit a, pokud jsou jemně rozptýleny v odpovídající koncentraci, mohou také reagovat výbušně, přičemž v každém případě vytvářejí oxid telluričitý TeO2. Stejně jako jiné kovové prachy, i telurový prášek může také explozivně reagovat s interhalogenovými sloučeninami, jako je bromid pentafluorid BrF5. Maximální koncentrace na pracovišti (MAK) pro telur nebyla stanovena.
důkaz
Elementární telur může být detekován v horké koncentrované kyselině sírové (H2SO4) oxidací telur za vzniku červeného kationtu Te42 + (tetratellurová dikace). Část kyseliny sírové se redukuje reakcí na kyselinu sírovou (H2SO3), která se rozkládá v důsledku vysokých teplot ve vodě (H2O) a jejího anhydridového oxidu siřičitého (SO2), který uniká jako plyn:
Barva čtvercového planárního Te42 + kationtu je způsobena šesti delokalizovanými elektrony π, které absorbují část viditelného světla. Zbývající neabsorbované vlnové délky světla dodávají komplementární barvě červenou.
Tellurát a tellurit lze specifikovat polarografií, tj. Selektivně určovat vedle sebe. Zatímco hladina telurátu je -1,66 V, hladina teluritu se objevuje při -1,22 V (vs. SCE, 0,1 M kaustická soda). Oba telluriové druhy jsou redukovány v jednom kroku na tellurid. Tímto způsobem jsou detekovatelné stopy 0,03% tellurátu nebo 0,003% telluritu. Významně silnější jsou metody atomové spektroskopie. Zatímco plamen AAS dosáhne detekčního limitu 20 μg / l, tato hodnota je mnohem nižší pro grafitovou trubici AAS (0,2 μg / l) a hydridovou techniku (0,02 μg / l).
tellurium
Ve sloučeninách se tellurium vyskytuje nejčastěji v oxidačních stavech -II (telluridy) a + IV (tetrahalidy, tellurium dioxid a telluráty (IV), zastaralé tellurity). Vzácnější jsou oxidační stavy + VI (teluráty (VI)) a + II (dihalidy), jakož i -I (ditelluridy) a + I (monohalidy, známé pouze jako TeI).
sloučeniny vodíku
Telluric Hydrogen H2Te je bezbarvý, vysoce toxický plyn produkovaný reakcí telluridů (MxTey) se silnými kyselinami, jako je kyselina chlorovodíková HC1. Z prvků (vodík a telur) může být sloučenina představována jako silně endotermická sloučenina pouze při teplotách vyšších než 650 ° C. Rozpuštěný ve vodě (kyselina telurová), reaguje kysele, kyselost přibližně odpovídá kyselině fosforečné. Ve vzduchu se vodný roztok okamžitě rozkládá na vodu a elementární telur.
kyslíkaté sloučeniny
Oxid telurnatý (oxid telurnatý) TeO2 je bezbarvá krystalická pevná látka a nejdůležitější oxid teluria. Vyplývá to ze spalování elementárního teluru se vzduchem. Je to anhydrid slabě amfoterní a nestabilní kyseliny telurové H2TeO3. Oxid telurnatý existuje v ortorombické (telluritové) a tetragonální (paratelluritové) modifikaci, která se také vyskytuje v přírodě jako minerály.
Oxid telurnatý (oxid telurnatý (VI)) TeO3 je žlutá, trigonální / rhombohedrální krystalizující pevná látka a anhydrid kyseliny orthotellurové H6TeO6. Vyplývá to z odtoku kyseliny orthotellurové silným zvýšením teploty. Žlutá barva je způsobena elektronovým přenosem kyslíku do teluria („přenos náboje“).
Oxid telurnatý (oxid telurnatý (II)) TeO je další, ale za standardních podmínek nestabilní oxid teluria. Je popisována jako černá amorfní pevná látka a reaguje ve vlhkém vzduchu s kyslíkem za vzniku stabilnějšího oxidu teluria TeO2.
Dicelulární oxid pentoxid (tellurium (IV) tellurium (VI) oxid) je směsný oxid teluria s kationty Te4 + a Te6 +. Kromě toho se k tepelnému rozkladu kyseliny orthotellurové krystalizuje další oxid trioxidu teluritého a krystalizuje se v monoklinickém krystalovém systému.
Telluráty jsou soli kyseliny orthotellurové H6TeO6 a kyseliny metatellurové H2TeO4 s anionty [TeO6] 6- nebo [TeO4] 2-. Soli kyseliny telurové H2TeO3 s aniontem [TeO3] 2- se nazývají telluráty (IV) (zastaralé tellurity).
halogenové sloučeniny
Tetrahalidy TeX4 s telurem v oxidačním stavu + IV jsou nejčastějšími halogenidy teluria. Jsou známy se všemi halogeny (fluor, chlor, brom a jod). Všechny sloučeniny jsou krystalické pevné látky.
Dihalidy TeX2 s tellurem v oxidačním stavu + II jsou známy pouze s chlorem, bromem a jodem, existují pouze v plynné fázi.
Monohalidy TeX existují s telurem pouze s jodem jako TeI s jodidem teluria. Je to jediný známý termodynamicky stabilní mono-jodid chalkogenů a tmavá krystalická pevná látka. Tellurium v této sloučenině má neobvyklý oxidační stav + I.
Subhalidy obsahují Te s oxidačním stavem, který je menší než + I. Stabilní zástupci jsou Te2I, Te2Br a Te3Cl2.
Hexahalidy TeX6 s tellurem v oxidačním stavu + VI jsou známy pouze jako hexafluorid teluria TeF6 nebo chlorid telafium-pentafluoridu TeF5Cl. Oba jsou bezbarvé plyny. Hexafluorid teluria je nejreaktivnější hexafluorid chalkogenu (kromě hexafluoridu sírového SF6 a hexafluoridu selenitého SeF6) a jako jediný je hydrolyzován ve vodě.
Kromě toho telurium v oxidačním stavu + IV ve vodném roztoku také komplexuje sloučeniny [TeX6] 2- (X = F-, Cl-, Br-, I-) se všemi halogenidovými ionty. S výjimkou hexafluoro komplexu jsou všechny ostatní struktury dokonale oktaedrální a mohou být také vysráženy jako soli z roztoku (například žlutý hexahloridotellurát amonný (IV) (NH4) 2 [TeCl6], červenohnědý hexabromidotellurát amonný (NH4) 2 [TeBr6] nebo černý hexaiodidotellurát cesia (IV) Cs2 [TeI6]).
Organotellurium spoje
Tellurium tvoří řadu organokovových sloučenin. Jsou však velmi nestabilní a při organické syntéze se jich málo používá. Jako čisté telanylové organylové sloučeniny ve formě R2Te, R2Te2, R4Te a R6Te (R jsou každý alkyl, aryl).
Kromě toho jsou také známy diorganotelurové dihalogenidy R2TeX2 (R = alkyl, aryl; X = F, Cl, Br, I) a triorganotellurhalidy R3TeX (R = alkyl, aryl, X = F, Cl, Br, I).
Tellurpolykationen
Polykation Te72+ v Te7[Be2Cl6]
Pečlivou oxidací teluru lze kromě již zmíněného Te42 + připravit a krystalizovat s vhodným protiiontem také mnoho polykationtů teluria Tenx +. Protiiion musí být slabá Lewisova báze, protože polykationty teluria jsou relativně silné Lewisovy kyseliny. Vhodnými oxidačními činidly jsou často halogenidy přechodných kovů, které při teplotách typicky 200 ° C poskytují přímo požadovanou sloučeninu:
Krystalizace je často úspěšná za podmínek chemického transportu, ale někdy musí být použita bezvodá rozpouštědla, jako je chlorid cíničitý nebo tetrabromid křemičitý. V některých případech jsou také vhodnými reakčními médii roztavené soli. Pokud halogenid kovu není vhodným oxidačním činidlem, jako je tomu obvykle u halogenidů prvků hlavní skupiny, lze jako oxidační činidla použít odpovídající halogenidy teluria:
Změnou protiiontu a reakčního média by mohla být představována široká škála polykationtů; Smíšené polykationty selenu a teluria jsou také dostupné vhodným výběrem reakčních složek syntézy. Kromě znázorněných řetězců nebo pásových polykationtů existují také izolované polykationty jako Te62 +, Te64 + a Te84 +.
Cena teluria
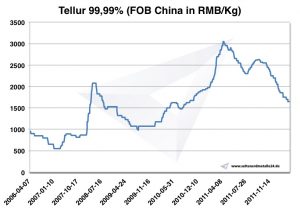
Graf Tellurium 2006-2011
Ceny teluru -> ceny strategických kovů










![{\ mathrm {8 \ Te \ + \ 2 \ UBr_ {5} \ longrightarrow \ Te_ {8} [U_ {2} Br _ {{10}}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/766123b2cbd2af42e846172c00731419fb95bc1b)
![{\ mathrm {13 \ Te \ + \ TeCl_ {4} \ + \ 4 \ BeCl_ {2} \ longrightarrow \ 2 \ Te_ {7} [Be_ {2} Cl_ {6}]}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c1d391160b6e1fdb357b4a11ea7abd720a1cb0ba)
