Zirkonium, Zr, atomové číslo 40
Cena, výskyt, těžba a použití zirkonia
Zirkonium, často také zirkon, je chemický prvek se symbolem prvku Zr a pořadovým číslem 40. Název pochází ze zirkonu, nejběžnějšího zirkoniového minerálu. V periodické tabulce je v 5. období; je to druhý prvek 4u. Skupina (zastaralá podskupina 4) nebo skupina titanů. Zirkon je těžký kov odolný vůči korozi. Biologické funkce nejsou známy; je přítomna v malém množství (4 mg / kg) v lidském organismu a není toxická.
Důležitý minerál zirkon obsahující zirkon (Zr [SiO4]) je od starověku známý jako drahokam. Zirkon jako prvek objevil v roce 1789 Martin Heinrich Klaproth ve vzorku minerálního zirkonu z Cejlonu a pojmenoval jej. Kov poprvé představil v roce 1824 Jöns Jakob Berzelius redukcí K.2ZRF6 s draslíkem. Aby to udělal, zahřál se "Směs hydrofluorické zirkoniové potaše s draslíkem v železné zkumavce". Po ošetření vodou, sušení a dlouhodobém zahřívání zředěnou kyselinou chlorovodíkovou dostal Berzelius a "Hrudkovitý prášek, který vypadá jako saze byl a jediný "Stiskem leštící oceli tmavě šedou barvu a lesk" obdržel. Správnou atomovou hmotnost naopak nebylo možné určit až do roku 1924, protože - kromě chyb při provádění experimentů - nebylo známo, že zirkonium vždy obsahuje malé množství hafnia. Bez této informace dávala měření vždy trochu příliš vysokou atomovou hmotnost. První praktická aplikace zirkonia byla jako bezdýmný bleskový prášek.
výskyt
Zirkonium se vyskytuje v zemské kůře s obsahem asi 0,016%. V seznamu prvků seřazených podle frekvence je zirkonium na 18u. Umístěte a je běžnější než známé prvky chloru a mědi. Ačkoli je velmi rozšířený, obvykle se vyskytuje pouze ve velmi malém množství a ve velmi malých krystalech (obvykle kolem 0,1 mm). Proto byl zirkonium považováno za vzácné ve starověku. Zirkonium se vyskytuje hlavně v křemičitých rušivých horninách, jako je žula. Nepochází to důstojně, ale pouze u některých minerálů, zejména jako zirkon (ZrSiO4) a Baddeleyit (ZrO2) a vzácnější červený eudialyt (Na4(CaCeFeMn)2ZrSi6O17(OHCl)2). Téměř vždy je spojeno s hafniem. Zirkonium je díky své vysoké teplotě tání 2550 ° C, jeho vysoké tvrdosti a nízké reaktivitě nejstarším minerálem, který lze nalézt na Zemi, a lze jej použít pro radiometrická stanovení věku na základě zabudovaných izotopů uranu a thoria.
Jako suroviny se většinou používají sekundární usazeniny, tzv. Mýdlové usazeniny. K nim dochází, když je okolní skála zvětralá a zůstane pouze zirkon zvláště odolný vůči povětrnostním vlivům. Další takové usazeniny mohou vznikat z vodních proudů, které vyplavují krystaly zirkonia a umývají je na jiných místech. Na druhé straně primární ložiska obvykle mají obsah zirkonia, který je příliš nízký pro výnosnou těžbu.

Časový rozvoj propagace zirkonu
Nejvýznamnější ložiska zirkonia jsou v Austrálii, USA a Brazílii. S obnovitelnými zásobami 38 milionů tun byla světová roční produkce zirkoniových minerálů 2006 na 920.000 tun (počítáno jako zirkonium). Z toho je pouze asi 5% zpracováno na kov a slitiny. Hlavními producentskými zeměmi byly 2006 z daleké Austrálie a Jižní Afriky.
Extrakce a prezentace
Zirkon, nejběžnější surovina zirkonia, musí být před dalším zpracováním nejprve převeden na oxid zirkoničitý. K tomu se zirkon vaří v tavenině hydroxidu sodného (alkalické trávení). Zirkon se potom nechá reagovat s koksem v oblouku za vzniku karbonitridu zirkonia (zirkonium obsahující uhlík a dusík) a potom s chlorem za vzniku chloridu zirkoničitého.

Přímá redukce oxidu zirkoničitého uhlíkem (jako ve vysokopecním procesu) není možná, protože vytvořené karbidy se velmi těžko oddělují od kovu. Místo toho se chlorid zirkoničitý redukuje na kov zirkonia v takzvaném Krollově procesu s hořčíkem v heliové atmosféře.

Van-Arkel-de-Boerův proces se používá k získání čistšího zirkonia. Během zahřívání ve vakuu zirkonium zpočátku reaguje s jodem za vzniku jodidu zirkoničitého. To se znovu rozloží na zirkon a jod na horkém drátu:

Tetraiodid zirkonia se tvoří ze zirkonia a jodu při 200 ° C; znovu se rozpadá při 1300 ° C
Zirkonium a hafnium nelze oddělit jednoduchým chemickým způsobem. Proto i toto vysoce čisté zirkonium stále obsahuje hafnium. Protože pro mnoho aplikací v reaktorové technologii je důležité, že zirkonium již neobsahuje hafnium, hrají separační procesy pro tyto dva kovy důležitou roli. Jednou z možností je metoda extrakce, při které se využívá různá rozpustnost sloučenin zirkonia a hafnia ve zvláštních rozpouštědlech. Často se využívají thiokyanáty a jejich různá rozpustnost v methylisobutylketonu. Dalšími možnostmi jsou iontoměniče nebo frakční destilace vhodných sloučenin.
Eigenschaften
Fyzikální vlastnosti

Krystalová struktura a-zirkonia
Zirkonium je stříbřitě lesklý těžký kov (hustota 6,501 g / cm)3 při 25 ° C), externě se podobá oceli. Kov krystalizuje ve dvou různých modifikacích, ve kterých může být převeden změnou teploty. Pod 870 ° C krystalizuje α-zirkonium v hexagonálním krystalovém systému (hexagonální hustá koule, typ hořčíku) ve vesmírné skupině 6/ mmm s parametry mřížky a = 323 pm a c = 514 pm, jakož i dvěma jednotkami vzorce na jednotku buňky. Při 870 ° C se krystalická struktura mění s kubickou středovou β strukturou (wolframový typ) s prostorovou skupinou  a mřížkový parametr a = 361 pm.
a mřížkový parametr a = 361 pm.
Zirkon je relativně měkký a flexibilní. Lze jej snadno zpracovat válcováním, kováním a příklepem. Stává se však křehkým a obtížně zpracovatelným vzhledem k nízké úrovni kontaminace vodíku, uhlíku nebo dusíku v kovu. Elektrická vodivost není tak dobrá jako vodivost ostatních kovů. Je to jen asi 4% z mědi. Naproti tomu je zirkonium dobrým vodičem tepla. Bod tání a bod varu jsou ve srovnání s lehčím homologním titanem o něco vyšší (bod tání: titan: 1667 ° C, zirkonium: 1857 ° C). Rovněž elektrická a tepelná vodivost je lepší. Pod 0,55 K se zirkonium stává supravodivým.
Vlastnosti zirkonia a těžšího homologního hafnia jsou velmi podobné kvůli kontrakci lanthanidu. To vyžaduje podobné atomové poloměry (Zr: 159 pm, Hf: 156 pm) a tedy podobné vlastnosti. Oba kovy se značně liší svou hustotou (Zr: 6,5 g / cm3, Hf: 13,3 g / cm3).
Důležitou vlastností, kvůli které zirkonium získalo při konstrukci reaktorů velký význam, je jeho malý průřez zachytávání neutronů. V této vlastnosti se zirkonium také velmi liší od hafnia. Díky tomu je pro tyto aplikace složitý separační proces nezbytný.
Chemické vlastnosti
Zirkon je základní kov, který reaguje s mnoha nekovy, zejména při vysokých teplotách. Hlavně jako prášek hoří bílým plamenem za vzniku oxidu zirkoničitého, v přítomnosti dusíku také na nitrid zirkonu a oxynitrid zirkoničitý. Kompaktní kov reaguje s kyslíkem a dusíkem pouze v případě, že je to bílé teplo. Za zvýšeného tlaku zirkonium reaguje s kyslíkem i při teplotě místnosti, protože vytvořený oxid zirkoničitý je rozpustný v roztaveném kovu.
Zirkon je pasivován ve vzduchu tenkou, velmi hustou vrstvou oxidu zirkoničitého, a je proto inertní. Je proto nerozpustný téměř ve všech kyselinách, pouze aqua regia a kyselina fluorovodíková napadají zirkonium při pokojové teplotě. Vodné báze nereagují se zirkoniem.
izotop
Existuje mnoho izotopů zirkonia mezi nimi 78Zr a 110Zr známý. Přírodní zirkonium je smíšený prvek skládající se z pěti izotopů. To jsou 90Zr, který se vyskytuje nejčastěji s podílem 51,45% přírodního zirkonia, stejně jako těžší izotopy 91Zr (11,32%), 92Zr (17,19%), 94Zr (17,28%) a 96Zr s 2,76% podílem. 96Zr je jediný přirozený izotop, který je slabě radioaktivní; rozpadá se s poločasem 2418 Let pod dvojitým rozpadem beta 96Mo. Izotop 91Zr lze detekovat pomocí NMR spektroskopie.
Verwendung
 Důležitým využitím zirkonia jsou uranové pláště uranových palivových článků v jaderných elektrárnách. Tato slitina sestává z přibližně 90% zirkonia a malého množství cínu, železa, chrómu nebo niklu, ale nesmí obsahovat hafnium. Důvodem pro výběr tohoto prvku je již popsaný průřez s nízkým záchytem pro tepelné neutrony se současně vysokou odolností proti korozi, díky čemuž je také vhodný jako stavební materiál pro chemické závody, zejména pro speciální části zařízení, jako jsou ventily, čerpadla, potrubí a výměníky tepla. Jako přísada do oceli zvyšuje odolnost proti korozi. Chirurgické nástroje jsou vyráběny z vhodných slitin.
Důležitým využitím zirkonia jsou uranové pláště uranových palivových článků v jaderných elektrárnách. Tato slitina sestává z přibližně 90% zirkonia a malého množství cínu, železa, chrómu nebo niklu, ale nesmí obsahovat hafnium. Důvodem pro výběr tohoto prvku je již popsaný průřez s nízkým záchytem pro tepelné neutrony se současně vysokou odolností proti korozi, díky čemuž je také vhodný jako stavební materiál pro chemické závody, zejména pro speciální části zařízení, jako jsou ventily, čerpadla, potrubí a výměníky tepla. Jako přísada do oceli zvyšuje odolnost proti korozi. Chirurgické nástroje jsou vyráběny z vhodných slitin.
Protože zirkonium reaguje s malým množstvím kyslíku a dusíku, lze jej použít jako getrový materiál ve žárovkách a vakuových systémech k udržení vakua. Tato vlastnost se také používá v metalurgii k odstranění kyslíku, dusíku a síry z oceli.
Kvůli jeho schopnosti vydávat velmi jasné světlo, když hoří, to bylo používáno kromě hořčíku jako bleskový prášek. Na rozdíl od hořčíku má zirkonium tu výhodu, že je bez kouře. Tuto funkci využívají také ohňostroje a signální světla.
Zirkonium vyzařuje jiskry, když narazí na kovové povrchy a je hořlavé. Armáda to používá u některých typů munice, jako je speciální broková munice Dragon's Breath a americká univerzální klouzavá bomba AGM-154 JSOW. Ve filmové technologii se tento efekt používá pro nepyrotechnické dopadové účinky, například kulky na kovové povrchy.
Slitiny zirkonia a niobu jsou supravodivé a zůstávají tak i při použití silných magnetických polí. Používají se proto pro supravodivé magnety.
Kromě kamenců obsahujících hliník se při „bílém vydělávání“ kůže používají soli zirkonia.
bezpečnost
Nejsou známy žádné toxické účinky zirkonia a jeho sloučenin. Díky husté oxidové vrstvě není kompaktní zirkonium hořlavé. Na druhou stranu v práškové formě může při zahřátí na vzduchu začít hořet. Požáry zirkonia jsou velmi nebezpečné, protože je nelze použít k hašení vody (intenzivní reakce s tvorbou vodíku), ani oxidu uhličitého nebo halonu. Požáry zirkonia musí být uhaseny kovovými hasicími přístroji (třída D) nebo suchým pískem.
důkaz
S Alizarin Red-S tvoří kyselina zirkonová charakteristickou sloučeninu červeno-fialové (barevné jezero), která zmizí po přidání fluoridových iontů za vzniku fluoro komplexu zirkonia. Tato reakce může sloužit jako kvalitativní detekce zirkonia i fluoru. Protože i malé množství fluoridu (a dalších aniontů) interferuje, je tato detekce nevhodná pro analýzu minerálů. Kromě toho jsou jako detekční činidlo vhodné některé jiné organické sloučeniny, jako je tanin, Kupferron, kyselina fenylarsonová, oxin nebo xylenolová oranžová. Další charakteristickou sloučeninou je chlorid zirkoničitý ZrOCl2 · 8 H2O, která krystalizuje v typických jehličkách. V moderní analýze může být zirkonium detekováno atomovou absorpční spektrometrií (AAS) nebo hmotnostní spektrometrií (také izotopovým vzorem).
Jednou z možností pro kvantitativní analýzu je srážení těžce rozpustného hydroxidu zirkoničitého amoniakem a následná kalcinace na zirkonium.

- Srážení hydroxidu
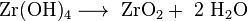
- Převeďte na vážicí formu
Připojení
Jako obecný kov tvoří zirkonium velké množství sloučenin. Většina sloučenin zirkonia jsou soli. Často jsou velmi stabilní a mají vysokou teplotu tání. Oxidační stav + IV je preferován a nejstabilnější. Existují ale také sloučeniny v oxidačních stavech + III až + I a v komplexech dokonce i ve stavech 0, −I a −II.
zirkon
 Nejdůležitější sloučeninou zirkonia je oxid zirkoničitý ZrO2, velmi stabilní a žáruvzdorný oxid. Oxid zirkoničitý se používá k výrobě žáruvzdorných vyzdívek v kelímcích a pecích. Aby se však mohl použít, musí být stabilizován vápníkem, yttrií nebo magnézií, aby se stabilizovala kubická vysokoteplotní fáze. Kromě toho se používá jako abrazivní a kvůli bílé barvě jako bílý pigment pro porcelán.
Nejdůležitější sloučeninou zirkonia je oxid zirkoničitý ZrO2, velmi stabilní a žáruvzdorný oxid. Oxid zirkoničitý se používá k výrobě žáruvzdorných vyzdívek v kelímcích a pecích. Aby se však mohl použít, musí být stabilizován vápníkem, yttrií nebo magnézií, aby se stabilizovala kubická vysokoteplotní fáze. Kromě toho se používá jako abrazivní a kvůli bílé barvě jako bílý pigment pro porcelán.
Krystaly oxidu zirkoničitého jsou bezbarvé a mají vysoký index lomu. Proto se používají pod názvem zirkonium jako umělý drahokam a náhražka diamantů.
Pokud je oxid zirkoničitý smíchán s oxidem yttritým, vyvstávají další možnosti aplikace. Při třech procentech obsahu oxidu yttritého je ZrO2 stabilizovaný v deformované fluoritové struktuře. Výsledkem je, že působí jako vodič kyslíkových iontů při teplotách vyšších než 300 ° C. Důležitou aplikací je Lambda sonda v automobilech, která se používá k měření obsahu kyslíku ve výfukových plynech pro katalyzátor. Při obsahu 15% yttrie vyzařuje zirkonie velmi jasné bílé světlo při teplotě 1000 ° C. Používá se v tzv. Aplikaci lamp Nernst. Protože keramika yttrium-zirkonia má extrémně vysokou lomovou houževnatost, používají se například ve stomatologii jako vysoce stabilní kostra koruny a můstku, v umělých kyčelních kloubech a zubních implantátech nebo jako spojovací prvek v dalekohledech. Přitom ve své funkci stále častěji nahrazují zlato a jiné kovy.
Zirkonium se také často používá pro kuličková ložiska. Speciálně pro závody ložisek, ZrO2 velká výhoda, že koeficient tepelné roztažnosti je blízký koeficientu oceli. Ostatní technické keramiky, jako je nitrid křemíku, mají obvykle podstatně nižší koeficient tepelné roztažnosti.
halogenidy
S halogeny fluorem, chlorem, bromem a jodem tvoří zirkonium několik sérií sloučenin. Všechny halogeny jsou sloučeniny ve formě ZrX4, ZrX3 a ZrX2 známý. Kromě toho existují chloridy, bromidy a jodidy ve formě ZrX. Nejstabilnější jsou tetrahalogenidy formy ZrX4, Není známo, že žádný z halogenidů zirkonia nemá důležité aplikace, přičemž chloridy zirkonia jsou meziprodukty při přípravě čistého zirkonia.
Další sloučeniny zirkonia
Křemičitan zirkoničitý, ZrSiO4, známější pod minerálním názvem zirkon, je nejběžnější sloučeninou zirkonia v přírodě. Je nejdůležitějším zdrojem zirkonia a jeho sloučenin. Zirkon se také používá jako drahokam.
Organické sloučeniny zirkonia jsou většinou nestabilní. Organické komplexy zirkonia, tzv. zirkonoceny, s radikály, jako je cyklopentadienyl. Jsou technicky důležité jako katalyzátory při polymeraci alkenů, zejména pro výrobu polypropylenu. Další aplikace organické sloučeniny zirkonia je v EU hydrozirconation, Tyto alkeny používají Schwartzovo činidlo Cp2ZrHCl (Cp = cyklopentadienyl) převedený na alkoholy nebo halogenované uhlovodíky. Při reakci koncových alkinů s Schwartzovým činidlem vznikají v hydrozirkonační trisubstituované dvojné vazby, další reakce s elektrofilním činidlem vede k trans-funkcionalizovaným alkenům ve vysoké stereochemické čistotě.
Jako antiperspirant lze použít komplexy hliník-zirkonium.
Hexafluoridozirkonát draselný (IV) K2ZRF6 (CAS: 16923-95-8) lze použít k oddělení zirkonia od hafnia.
Uhličitan zirkoničitý existuje jako základní komplex. Používá se mimo jiné v papírenském průmyslu.
| Obvykle | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Jméno, symbol, atomové číslo | Zirkonium, Zr, 40 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie | Přechodné kovy | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupina, období, blok | 4, 5, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| vzhled | stříbřitě bílá | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| číslo CAS | 7440-67-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hmotnostní zlomek zemského pláště | 0,021% | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| jaderný | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| atomová hmotnost | 91,224 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomový poloměr (vypočítaný) | 155 (206) hodin | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalentní poloměr | 148 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| elektronová konfigurace | [Kr] 4d2 5s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. ionizace | 640,1 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. ionizace | 1270 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. ionizace | 2218 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. ionizace | 3313 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| fyzicky | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| fyzický stav | fest | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| modifikace | dva (a- / β-Zr) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| krystalová struktura | šestihranný; kubický> 1140 K (867 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| hustota | 6,501 g / cm3 (25 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| tvrdost Mohs | 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| magnetismus | paramagnetické ( = 1,1 10-4) = 1,1 10-4) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| bod tání | 2130 K (1857 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| bod varu | 4682 K (4409 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molární objem | 14,02 · 10-6 m3/ mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Výparné teplo | 590,5 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| skupenské teplo tání | 16,9 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| tlak páry | 0,00168 Pa při 2125 K. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rychlost zvuku | 4650 (dlouhý), 2250 (trans.) M / s při 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Měrná tepelná kapacita | 270,0 J / (kg · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrická vodivost | 2,36 · 106 A / (V · m) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| tepelná vodivost | 22,7 W / (m K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| chemický | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| oxidační stavy | 4, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| normální potenciál | -1,553 V (ZrO2 + 4 H.+ + 4 e- → Zr + 2 H2O) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| electronegativity | 1,33 (Paulingova stupnice) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| izotop | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
| vlastnosti NMR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
| bezpečnost | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ceny zirkonia
Cena zirkonia -> ceny strategických kovů


