Scandium, Sc, atomové číslo 21
obecný
Skandium (z latinského Skandinávie „Skandinávie“) je chemický prvek se symbolem Sc a atomovým číslem 21.
V periodické tabulce je v 3. Podskupina (skupina 3) nebo skandiová skupina. Měkký, stříbro-bílý prvek je první z přechodných kovů a je také připisován kovům vzácných zemin.

Skandium metal
Scandium objevil 1879 Lars Fredrik Nilson. Z 10 kg euxenitu a gadolinitu izoloval oxid s dosud neznámými vlastnostmi. Na počest své vlasti nazval nový živel „Skandium“. Již 1869 Dmitrij Ivanovič Mendelejev předpovídal prvek Eka-Bor s atomovým číslem 21. Pouze Per Teodor Cleve později uznal souhlas skandia s Eka-boronem Pure Scandium 1937 byl poprvé vyroben elektrolyticky z eutektické taveniny draslíku, lithia a chloridu skandia při 700 až 800 ° C.
Skandium je jedním ze vzácných prvků. Elementární to nenastane, jen v některých vzácných nerostech jeden najde to v obohacené formě:
Thortveitit: (Sc, Y) 2Si2O7
Euxenit: (Y, Ca, Ce, U, Th) (Nb, Ta, Ti) 2O6
Gadolinit Y2Fe2+Be2Si2O10
Ixiolit: (Ta, Nb, Sn, Mn, Fe) 4O8
Bazzit: (Sc, Al) 2Be3Si6O18
Kolbeckite: ScPO4 · 2 H2O
Periodická tabulka skandium-21
Skandium se vyskytuje v nízkých koncentracích ve více než 800 minerálech. Je proto také zahrnut do rudných koncentrátů přechodných kovů jako „nečistota“. Patří sem ruské a čínské wolframové a tantalitové koncentráty. Sloučeniny skandia se také vyrábějí při zpracování rud obsahujících uran.
Modrá barva akvamarinu, různých berylů, je způsobena ionty Sc3 +.
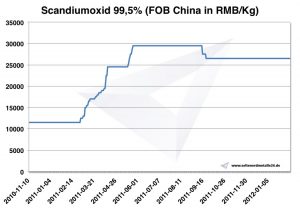
Graf scandium oxide 2010-2012
zotavení
Výchozím materiálem je hlavně thortveitit, který se v několika krocích zpracovává na oxid skandia. Kovový skandium se pak vytváří přeměnou na fluorid a redukcí vápníkem.
Funkce
Skandium je díky své hustotě jedním z lehkých kovů. Ve vzduchu se stává matným, vytváří ochrannou vrstvu nažloutlého oxidu. Skandium reaguje se zředěnými kyselinami za vzniku vodíku a trojmocných kationtů. Ve vodní páře od 600 ° C, reakce na Scandiumoxid Sc2O3. Ve vodných roztocích se kationty chovají podobně jako hliník, což často způsobuje potíže při analytických separacích. Měl by být stabilní ve směsi kyseliny dusičné a 48% fluorovodíku.
Verwendung
Jeho hlavní aplikace najde skandium jako skandium jodid ve vysoce výkonných vysokotlakých rtuťových výbojkách, například pro osvětlení stadionů. Spolu s holmiem a dysprosiem se vytváří světlo podobné dennímu světlu. Skandium se také používá k výrobě laserových krystalů. Ke zvýšení Ummagnetisierungsgeschwindigkeit je přidán oxid skandia pro ukládání magnetických dat. Skandium jako skandiumchlorid se používá v mikro veličinách jako velmi důležitá složka katalyzátoru při výrobě chlorovodíku.
Jako legující aditivum skandium vykazuje účinky na stabilizaci struktury a zrnitosti. Slitina hliníku a lithia s nízkým přídavkem skandia se používá k výrobě některých součástí ruských stíhacích letadel. Slitiny Scandium se také používají v moderním cyklistickém průmyslu (viz silniční kolo). Tyto slitiny také obsahují relativně malé skandium.
Prášek Scandium je hořlavý, a proto je klasifikován jako hořlavý.
| Obvykle | |
| Jméno, symbol
pořadový |
Scandium, Dc, 21 |
| Serie | Přechodné kovy |
| Skupina, období, blok | 3, 4, d |
| vzhled | stříbřitě bílá |
| číslo CAS | 7440-20-2 |
| Hmotnostní zlomek zemské obálky | 5,1 ppm |
| jaderný | |
| atomová hmotnost | 44,955910 u |
| poloměr atomu | 160 pm |
| Kovalentní poloměr | 170 pm |
| Elektronenkonf. | [Ar] 3d (1) 4s2 |
| 1. ionizace | 633,1 KJ / mol |
| 2. ionizace | 1235,0 KJ / mol |
| 3. ionizace | 2388,6 KJ / mol |
| fyzicky | |
| fyzický stav | fest |
| krystalová struktura | šestihranný |
| hustota | 2,985 g / cm3 |
| magnetismus | paramagnetický (χm = 2,6 * 10 (-4)) |
| bod tání | 1814 K (1541 C) |
| bod varu | 3103 K (2830 C) |
| Molární objem | 15,00 * 10 (-6) m (3) / mol |
| Výparné teplo | 318 KJ / mol |
| skupenské teplo tání | 16,0 KJ / mol |
| Elektrická vodivost | 1,81 * 10 (6) A / (V * m) |
| tepelná vodivost | 16 W / (m * K) |
