Chrom, Cr, atomové číslo 24
Chrom - Extrakce chromu, použití, ceny
obecný
Chrom (alt. Χρῶμα chrṓma, color ') je chemický prvek se symbolem Cr a atomovým číslem 24. Patří k přechodným kovům, v periodické tabulce je v 6. Podskupina (skupina 6) nebo skupina chrómu. Sloučeniny chrómu mají mnoho různých barev a často se používají jako pigmenty v barvách a lacích.
zotavení
Vytěžená chromitová ruda je uvolněna z mrtvé horniny. Ve druhém kroku probíhá oxidační digesce při přibližně 1200 ° C, čímž se získá chroman:
Chroman sodný je extrahován horkou vodou a převeden na dichroman s kyselinou sírovou:
Dichroman sodný krystalizuje po ochlazení jako dihydrát z roztoku. Následnou redukcí uhlíkem se získá oxid chromitý:
Poté následuje aluminotermická redukce oxidu chromitého na chrom:
Chrom nelze získat z oxidických rud redukcí uhlím, protože tak vzniká karbid chrómu. Čistší chrom je vyroben elektrolytickým ukládáním Cr3+Jsou zobrazeny ionty z roztoku kyseliny sírové. Odpovídající roztoky se připravují rozpuštěním oxidu chromitého nebo ferrochromu v kyselině sírové. Ferrochrom jako výchozí materiál však vyžaduje předchozí separaci železa.
Extrémně čistý chrom se vyrábí dalšími kroky čištění pomocí procesu van-Arkel-de-Boer.
Ferrochrom se vyrábí redukcí chromitu v elektrické obloukové peci při 2800 ° C.
Eigenschaften
Chrom je stříbrně bílý, korozivzdorný a zakalený odolný tvrdý kov, který je houževnatý, tvárný a tvárný v původním stavu. Je antiferomagnetický s teplotou Néel 475 K.[11] Chrom se po určité době s vývojem vodíku rozpustí v kyselině chlorovodíkové a kyselině sírové, když ochranná vrstva oxidu zmizí. Běžné oxidační úrovně chromu jsou +2, +3 a +6, přičemž +3 jsou nejtrvalejší.
Cr (II) je d4-Konfigurace je nestabilní. Sotva existuje jiné redukční činidlo, které absorbuje kyslík ze vzduchu tak rychle jako Cr (II). Ale i bez vstupu vzduchu, Cr2+-Roztoky jsou stabilní pouze na krátkou dobu, pokud jsou získány z nejčistšího chromu (např. Elektrolytového chromu).
Cr3+ je nejstabilnější forma. To je vysvětleno teorií krystalového pole, podle které d3 Konfigurace je stabilizována poloplněnou spodní skořepinou.
Cr (VI) jako chromát (CrO42-) nebo dichroman (Cr2O72-) se používá jako silné oxidační činidlo. Je toxický a karcinogenní. Ve vodných roztocích existuje chemická rovnováha mezi dvěma ionty, která je závislá na pH. Pokud okyselíte zředěný roztok žlutého chromanu, dostanete H.+-Ionty, podle LeChateliera se rovnováha posune ve směru dichromátu, roztok se zbarví oranžově.

- Bezpečnostní pokyny a biologický význam
Role Cr (III) (Cr3+Ionty) v lidském těle jsou v současné době předmětem kontroverzí. Existují náznaky, že Cr (III) může hrát roli v metabolismu sacharidů a tuků u savců. Tyto informace jsou v současné době sledovány. Dřívější náznaky, že oblíbený doplněk stravy Cr (III) -picolinát příznivě působí na stavbu těla, nebylo možné v pozdějších studiích potvrdit. Studie s křeččími buňkami ukázala, že pikolinát Cr (III) je mutagenní a může způsobit rakovinu.
Aktuálně dostupné údaje naznačují, že je velmi nepravděpodobné, že by trpěl nedostatkem chromu. Ještě vyšší dávky Cr (III) vyvolávají toxický účinek jen s obtížemi, protože produkt rozpustnosti hydroxidu Cr (III) je extrémně nízký (6,7 x 10-31). Je proto pravděpodobně velmi obtížné vstřebávat v lidském střevě. V USA byla doporučená úroveň příjmu Cr (III) snížena z 50–200 µg / den na 35 µg / den u dospělých mužů a na 25 µg / den u dospělých žen.
Sloučeniny Cr (VI) jsou extrémně toxické. Jsou mutagenní a poškozují DNA. Vstupují do těla dýchacími cestami a poškozují plicní tkáň. Lidé chronicky vystavení těmto sloučeninám jsou vystaveni zvýšenému riziku vzniku rakoviny plic. Jedovatý účinek se zvyšuje s nerozpustností soli. Směrnice RoHS přísně omezuje použití sloučenin Cr (VI) v Evropě.
Verwendung
Chrom a sloučeniny chrómu se používají v široké škále aplikací, kde se používá jeho trvanlivost:
- tvrdé chromování: galvanické nanášení ochranné vrstvy proti opotřebení do tloušťky 1 mm přímo na ocel, litinu, měď. Hliník lze také pochromovat po nanesení mezivrstvy (tvrdé chromované hliníkové válce v konstrukci motoru).
- Dekorverchromung: galvanické nanášení vrstvy Cr o tloušťce <1 μm jako dekorace s mezikontáží protikorozní ochrany z niklu nebo nikl-mědi Plastové díly jsou také velmi často pochromované. Náhradou za dekorativní chromování je proces achrolytu.
- passivation galvanické zinkové vrstvy (chromátování)
- legovací prvek: u korozivzdorných a žáruvzdorných nerezových ocelí a barevných kovů
- Katalyzátor: pro povolení nebo urychlení chemických reakcí
- chrom opalování: hlavní způsob výroby kůže
Připojení
- Chrome Oxide
- Oxid chromitý Cr2O3, se používá jako smaltovaná barva a pro barvení skla (zelené lahve) (také kolínský most zelený). To nelze zaměňovat s toxickou chromovou zelenou.
- chrome žlutý
- Chroman olovnatý (PbCrO)4, sloužící jako zářivě žlutý barevný pigment („Post yellow“). Díky své toxicitě je nyní téměř úplně nahrazen organickými barevnými pigmenty. V analýze se používá pro jodometrické stanovení olova.
Chromová žlutá, která se používá jako barva umělce, je síran olovnatý / chroman olovnatý (asi 2 PbSO4 · PbCrO4). Pigment objevil Louis-Nicolas Vauquelin v roce 1809 a komerčně se vyrábí v Německu od roku 1820. Chromová žlutá má vysokou krycí schopnost, její světelná stabilita závisí na žlutém tónu. Chromová žlutá se v olejomalbě používá jen zřídka. Vincent van Gogh však použil chromovou žlutou a. A. ve slavných slunečnicových malbách provedených v oleji na plátně. Dnes však některé z nich trpí změnou barvy žlutých tónů.
Umělecký technolog prof. Christoph Krekel ze Stuttgartské umělecké akademie o používání pigmentu chrome žlutý: "Malíři padli na chromově žlutou, protože je velmi brilantní žlutá - má velkou barevnou intenzitu, to znamená, že pomocí tohoto nového žlutého odstínu byste mohli vytvořit mnohem jasnější obraz".
Chromově žlutá je také důležitou barvou při analýze padělků „starých“ obrazů.
- chrom oxid
- Oxid chromitý CrO2, je černý feromagnetický prášek pro výrobu magnetických pásek s lepším poměrem signálu k šumu než běžné magnetické pásky z oxidu železitého, protože oxid chromitý má vyšší koercitivitu.
- kyselina chromová
- s hypotetickou strukturou H2Cro4 existuje pouze ve zředěném vodném roztoku. Je to velmi jedovaté. V některých chromanech a dichromanech existuje jako anion.
Anhydrid kyseliny chromové, velmi toxický oxid chromitý (Cr)3, je známý jako oxid chromitý.
Oranžový, velmi jedovatý dichroman draselný K.2Cr2O7 je silné oxidační činidlo: V roztoku kyseliny sírové se primární alkoholy snadno přeměňují na příslušné aldehydy, které lze použít pro semikvantitativní detekci alkoholu v dechu. V laboratorní oblasti to bylo ve formě kyselina chromová Používá se k čištění skla. Při kontaktu s chloridovými ionty je však těkavý, karcinogenní chromyl Cro2Cl2 vytvořen (odpočet!). Dichroman draselný se také používá jako titrant a jako fixátor v průmyslových barvicích lázních. Dichroman draselný a také velmi jedovatý dichroman amonný (NH4)2Cr2O7 jsou látkou citlivou na světlo v chromovaných želatinových vrstvách rané fotografie (viz proces jemného tisku).
- chromit
- (Chrom železná cihla, viz výše) FeCr2O4 se používá k výrobě forem pro spalování cihel.
Ceny chromu, grafy a historická data
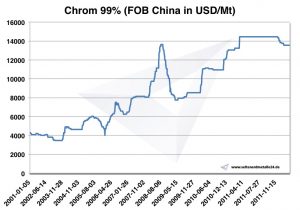
Graf Chrom 2001-2011








 = 3,1 10-4)
= 3,1 10-4)


