Yttrium, Y, atomové číslo 39
obecný
Yttrium [ʏtriʊm] je chemický prvek se symbolem prvku Y a pořadovým číslem 39. Patří k přechodným kovům a kovům vzácných zemin, v periodické tabulce je v 5. Období i 3. Podskupina (skupina 3) nebo skandiová skupina. Yttrium je pojmenováno po prvním místě, dole Ytterby poblíž Stockholmu, stejně jako Ytterbium, Terbium a Erbium.
Yttrium (z dolu Ytterby poblíž švédského hlavního města Stockholmu) objevil Johan Gadolin 1794 v Mineral Ytterbit. 1824 vyrobil Friedrich Wöhler kontaminované yttrium redukcí chloridu yttria draslíkem. Pouze 1842 následoval Carla Gustava Mosandera, který oddělil yttrium od doprovodných prvků erbium a terbium.
Yttrium se v přírodě nenachází v elementárním stavu. Minerály obsahující yttrium (Yttererden) jsou vždy spojovány s jinými kovy vzácných zemin. Může být také obsažen v uranových rudách. Monazitové písky s až 3% yttriem a bastnasit s 0,2% yttriem jsou komerčně rozložitelné. Navíc je hlavní složkou xenotimu (Y [PO4]).
Velké monazitvorkommen, začátek 19u. Tyto dvě země, objevené a využívané v Brazílii a Indii ve 20. století, se staly hlavními producenty yttriových rud. Pouze otevření horního důlního dolu v Kalifornii, které produkovalo velká množství bastnasitu až do 1990, z USA učinilo hlavního producenta yttria, ačkoli zde těžený bastnasit obsahuje pouze malé množství yttria. Od uzavření tohoto dolu je Čína největším producentem vzácných zemin 60%. Ty se získávají v dole poblíž Bayan Kuang, jejíž ruda obsahuje xenotim, a z iontů absorbujících jílových minerálů, které se těží hlavně v jižní Číně.

Yttriový kov
zotavení
Oddělení vzácných zemin od sebe je pracným krokem při výrobě yttria. Frakční krystalizace solných roztoků byla na začátku preferovanou metodou, která byla používána brzy pro separaci vzácných zemin v laboratorním měřítku. Pouze zavedení iontové chromatografie umožnilo oddělit vzácné zeminy v průmyslovém měřítku.
Koncentrovaný oxid yttria se převede na fluorid. Následně se redukuje na kov vápníkem ve vakuové indukční peci.
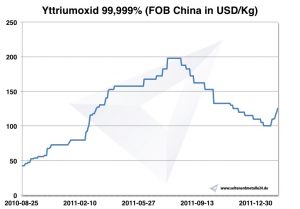
Graf oxid yttria 2010-2011
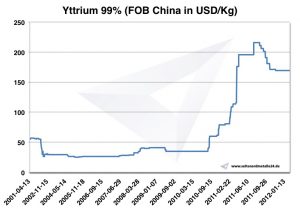
Graf Yttrium 2001-2012
Funkce
Yttrium je ve vzduchu relativně stabilní, ale pod světlem ztmavne. Při teplotách nad 400 ° C se mohou nová rozhraní vznítit. Jemně rozdělené yttrium je relativně nestabilní. Yttrium má nízký průřez záchytu neutronů.
Ve svých sloučeninách je většinou trojmocný. Existují však také klastrové sloučeniny, ve kterých může ytrium předpokládat oxidační stavy <3.
Existuje celkem izotopů 32 mezi 76Y a 108Y, jakož i další známé isomery jádra 24. Z nich je stabilní pouze jeden 89Y, z nichž výlučně existuje přírodní yttrium. Yttrium je jedním z čistých prvků 22. Nejstabilnější radioizotopy jsou 88Y s poločasem 106,65 dní a 91Y s poločasem 58,51 dní. Všechny ostatní izotopy mají poločas rozpadu kratší než jeden den, s výjimkou 87Y, který má poločas 79,8 hodin, a 90Y s 64 hodin. Izotopy yttria patří mezi nejčastější produkty štěpení uranu v jaderných reaktorech a při jaderných výbuchech.
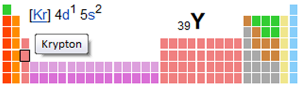
Periodická tabulka yttrium-39
Verwendung
Metalické yttrium se používá v technologii trubkových reaktorů. Slitina yttrium-kobalt může být použita jako permanentní magnet. Yttrium se používá jako materiál pro ohřev drátů v iontových zdrojích hmotnostních spektrometrů. V metalurgii se pro rafinaci zrna používají menší aditiva yttria, například ve slitinách žáruvzdorného železa, chromu, hliníku, chrómu, molybdenu, titanu a zirkonia. U slitin hliníku a hořčíku má posilující účinek. Technicky důležitější jsou oxidické sloučeniny yttria:
Dusičnan yttritý jako potahový materiál v plášti
Hliníkový granát Yttrium (YAG) slouží jako laserový krystal
Yttrium iron granát (YIG) jako mikrovlnný filtr
Yttriem stabilizovaný zirkon jako pevný elektrolyt v palivových článcích (SOFC, Fuel Oxide Fuel Cell)
Nejdůležitějším využitím oxidů yttria a oxidů yttria je všestrannost v trojmocných europiu (červená) a thulium (modrá) dopovaných fosforech (fosfory) v televizních obrazovkách, zářivkách a radarových zkumavkách.
Kromě toho se keramika a slitiny yttria používají v:
lambda sondy
Supravodiče (např. Oxid yttrium-barnatý-měď YBa2Cu3O7-x)
ODS slitiny
jiskra
Jako čistý beta emitor se 90Yttrium používá v nukleární medicíně pro terapii, například, Radiosynoviorthese.
Yttrium je považováno za nepodstatné a toxické (hodnota MAK = 5 mg / m3).
| Obvykle | ||
| Jméno, symbol
pořadový |
Yttrium, Y, 39 | |
| Serie | Přechodné kovy | |
| Skupina, období, blok | 3, 5, d | |
| vzhled | stříbřitě bílá | |
| číslo CAS | 7440-65-5 | |
| Hmotnostní zlomek zemské obálky | 26 ppm | |
| jaderný | ||
| atomová hmotnost | 88,90585 u | |
| poloměr atomu | 180 pm | |
| Kovalentní poloměr | 190 pm | |
| Elektronenkonf. | [Kr] 4d (1) 5s2 | |
| 1. ionizace | 600 KJ / mol | |
| 2. ionizace | 1180 KJ / mol | |
| 3. ionizace | 1980 KJ / mol | |
| fyzicky | ||
| fyzický stav | fest | |
| krystalová struktura | šestihranný | |
| hustota | 4,472 g / cm3 | |
| magnetismus | paramagnetický (χm = 1,2 * 10 (-4)) | |
| bod tání | 1799 K (1526 C) | |
| bod varu | 3609 K (3336 C) | |
| Molární objem | 19,88 * 10 (-6) m (3) / mol | |
| Výparné teplo | 380 KJ / mol | |
| skupenské teplo tání | 11,4 KJ / mol | |
| Elektrická vodivost | 1,66 * 10 (6) A / (V * m) | |
| tepelná vodivost | 17 W / (m * K) | |
