Hafnium je chemický prvek se symbolem Hf a atomovým číslem 72. Je pojmenován po latinském názvu města Kodaň, Hafniave kterém byl prvek objeven. Jedná se o stříbrošedý, lesklý, korozivzdorný přechodný kov, který je ve 4. podskupině (skupina 4) nebo titanové skupině v periodické tabulce.
Hafnium má velmi podobné vlastnosti jako zirkonium přímo nad ním v periodické tabulce. Biologické funkce nejsou známy, v lidském organismu se běžně nevyskytují a nejsou toxické.
Hafnium byl jedním z posledních stabilních prvků v periodické tabulce, které byly objeveny. První náznak existence dalšího prvku mezi lutetiem a tantalem vyplynul z Moseleyho zákona z roku 1912. V roce 1914 se Henry Moseley pokusil najít neznámý, ale očekávaný prvek s atomovým číslem 72 podle tohoto zákona ve vzorcích minerálů vzácných zemin (dnes lanthanoidů). Ale nebyl úspěšný.
Ve své práci o atomové teorii publikované v roce 1922 Niels Bohr předpověděl, že řada lanthanoidů s lutetiem skončí a že prvek 72 musí být proto podobný zirkoniu. Hafnium bylo možné detekovat jen o rok později: V roce 1923 jej Dirk Coster a George de Hevesy objevili v Kodani pomocí rentgenové spektroskopie v norském zirkoniu. Další výzkum dalších minerálů ukázal, že hafnium je vždy obsaženo v minerálech obsahujících zirkon. Jantzenovi a Hevesymu se podařilo je oddělit od zirkonia opakovanou krystalizací diamonia a fluoridů dvojdraselných dvou prvků. Elementární hafnium by pak bylo možné získat redukcí sodíkem.
výskyt
Hafnium s obsahem 4,9 ppm v kontinentální kůře není na Zemi příliš častým prvkem. Pokud jde o frekvenci, je srovnatelný s prvky bromu a cesia a častější než dlouho známé zlato a rtuť. Hafnium se nevyskytuje přirozeně ani ve vlastních minerálech. Na druhé straně minerály zirkonia, jako je zirkon a baddeleyit, vždy obsahují hafnium; množství hafnia je obvykle 2% obsahu zirkonia (1 - 5 procent hmotnostních hafnia). Jedním z mála minerálů, které obsahují více hafnia než zirkonia, je zirkonová odrůda Alvit [(Hf, Th, Zr) SiO4].
Analogicky k zirkoniu jsou nejdůležitějšími ložisky hafnia ložiska zirkonia v Austrálii a Jižní Africe. Zásoby se odhadují na 1,1 milionu tun (počítáno jako oxid hafnia).
Extrakce a prezentace
Pro získání hafnia je třeba jej oddělit od zirkonia. To není možné během výrobního procesu, ale probíhá to v samostatném procesu. K separaci se používají extrakční procesy. Používá se rozdílná rozpustnost určitých solí zirkonia a hafnia ve speciálních rozpouštědlech. Příkladem toho jsou různé rozpustnosti dusičnanů v tri-n-butylfosfátu a thiokyanátů v methylisobutylketonu. Další možné možnosti separace jsou iontoměniče a frakční destilace vhodných sloučenin.
Po Krollově procesu může být oddělené hafnium nejprve převedeno na chlorid hafnia (IV) a poté redukováno na elementární hafnium pomocí sodíku nebo hořčíku.
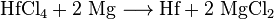
Pokud je třeba ještě čistší hafnium, lze použít proces Van Arkel de Boer. Během zahřívání ve vakuu hafnium zpočátku reaguje s jodem za vzniku jodidu hafnia (IV). To se znovu rozloží na hafnium a jod na horkém drátu.

Hafnium se vyrábí pouze v malém množství na stupnici od 100 tun. Nevyrábí se interně, ale je vedlejším produktem extrakce zirkonia bez hafnia pro palivové tyče.
Eigenschaften
Fyzikální vlastnosti

Krystalová struktura α-Hf, a = 320 hodin,c = 505 hod
Hafnium je stříbřitý, lesklý těžký kov s vysokou hustotou (13,31 g / cm)3). Krystalizuje ve dvou různých modifikacích v závislosti na teplotě. Za normálních podmínek krystalizuje v šestihranném těsném obalu koulí (α-Hf), a proto je izotypový vůči α-Zr, nad 1775 ° C se mění v kubickou strukturu zaměřenou na tělo (β-Hf).
Pokud je čistota hafnia vysoká, je relativně měkká a poddajná. Práce je snadná válcováním, kováním a kladivem. Pokud na druhé straně jsou v materiálu stopy kyslíku, dusíku nebo uhlíku, stane se křehký a obtížně zpracovatelný. Teploty tání a varu hafnia jsou nejvyšší ve skupině při 2227 ° C a 4450 ° C (teplota tání: titan: 1667 ° C, zirkonium: 1857 ° C).
Téměř ve všech ostatních vlastnostech se kov podobá světlejšímu homologu zirkonia. To je způsobeno kontrakcí lanthanidu, která způsobuje podobné atomové a iontové poloměry (atomové poloměry Zr: 159 pm, Hf: 156 pm). Výjimkou je hustota zirkonia s 6,5 g / cm3 má výrazně nižší hodnotu. Technicky důležitým rozdílem je, že hafnium může absorbovat neutrony 600krát lépe. To je důvod, proč musí být hafnium odděleno pro použití zirkonia v jaderných elektrárnách.
Hafnium supravodí pod teplotou přechodu 0,08 K.
Chemické vlastnosti
Hafnium je obecný kov, který při zahřívání reaguje s kyslíkem za vzniku oxidu hafnia. Za těchto podmínek také sloučeniny tvoří jiné nekovy, jako je dusík, uhlík, bór a křemík. Při pokojové teplotě se rychle vytvoří hustá vrstva oxidu, která pasivuje kov a chrání ho před další oxidací.
Hafnium je stabilní ve většině kyselin kvůli své pasivaci za normálních podmínek. Rychle koroduje v kyselině fluorovodíkové; znatelná koroze nastává v horké koncentrované kyselině sírové a fosforečné. Směsi kyseliny chlorovodíkové a kyseliny dusičné, včetně aqua regia, by měly být hafniu vystaveny pouze krátkodobě, a to i při pokojové teplotě; při 35 ° C je třeba počítat s rychlostí odstraňování větší než 3 mm / rok. Ve vodných základech je odolný až do teploty cca 100 ° C, úběr materiálu je obvykle menší než 0,1 mm / rok.
izotop
Existuje celkem 35 izotopů a 18 jaderných izomerů hafnia 153Hf to 188Hf známé. Přírodní hafnium je smíšený prvek, který se skládá z celkem šesti různých izotopů. Nejběžnější izotop je s frekvencí 35,08% 180Hf. Z toho vyplývá 178Hf s 27,28%, 177Hf s 18,61%, 179Hf s 13,62%, 176Hf s 5,27% a 174Hf 0,16%. Jediným přirozeným izotopem je 174Hf slabě radioaktivní, je to alfa zářič s poločasem 2 x 1015 Let. Izotopy 177Hf a 179Hf lze detekovat pomocí NMR spektroskopie.
Jádrový izomer 178 2mS poločasem 31 let má Hf dlouhou životnost a současně emituje silné gama záření 2,45 MeV, když se rozpadá. Jedná se o nejvyšší energii, kterou emituje izotop, který je stabilní po dlouhou dobu. Jednou z možných aplikací je použití tohoto základního izomeru jako zdroje ve výkonných laserech. V roce 1999 Carl Collins zjistil, že izomer může uvolnit svou energii jediným nárazem, když je vystaven rentgenovým paprskům. Možné aplikace, jako jsou výbušniny, jsou však nepravděpodobné.
Verwendung
Hafnium list z průmyslového odpadu
Protože je obtížné ho extrahovat, hafnium se používá pouze v malém množství. Hlavní oblastí použití je jaderná technologie, ve které se hafnium používá jako regulační tyč k regulaci řetězové reakce v jaderných reaktorech. Použití hafnia má několik výhod oproti jiným možným látkám absorbujícím neutrony. Prvek je velmi odolný proti korozi a jaderná reakce s neutrony vytváří izotopy hafnia, které mají také vysoké absorpční průřezy. Vzhledem k vysoké ceně je často vhodný pouze pro vojenské aplikace, například pro reaktory v jaderných ponorkách.
Existuje několik dalších použití. Hafnium reaguje rychle s malým množstvím kyslíku a dusíku, a lze jej proto použít jako getrovou látku k odstranění nejmenších množství těchto látek z ultravysokých vakuových systémů. Při hoření vyzařuje kov velmi jasné světlo. Je proto možné použít hafnium ve výbojkách se zvláště vysokou světelnou účinností. Z těchto prvků lze vyrobit několik velmi stabilních a vysoce tajících sloučenin, zejména nitrid hafnia a karbid hafnia.
Ve slitinách s kovy, jako je niob, tantal, molybden a wolfram, zvyšuje pevnost přídavek 2% hafnia. Jsou vytvořeny obzvláště stabilní, vysoce tavitelné a tepelně odolné materiály.
bezpečnost
Stejně jako mnoho jiných kovů je hafnium vysoce hořlavý a v jemně rozděleném stavu pyroforický. Na druhé straně v kompaktním stavu není hořlavý. Kov není toxický. Z těchto důvodů není při manipulaci s hafniem nutné dodržovat žádné zvláštní bezpečnostní předpisy.
Připojení
Hafnium tvoří řadu sloučenin. Jedná se většinou o soli nebo smíšené krystaly a často mají vysoké teploty tání. Nejdůležitějším oxidačním stavem hafnia je + IV, ale jsou známy sloučeniny v nižších oxidačních stavech, od 0 do + III, a v komplexech také negativní oxidační stavy.
Hafnium (IV) oxid
Oxid hafnia (IV) je velmi stabilní pevná látka s vysokou teplotou tání. Má vysokou relativní permitivitu 25 (pro srovnání: oxid křemičitý: 3,9). Lze jej proto použít jako vysoce dielektrikum k izolaci řídicího připojení (hradla) pro mikroprocesory. Dalším zmenšením šířky struktury se svodové proudy stávají stále větším problémem, protože miniaturizace struktur CMOS vyžaduje také tenčí izolaci brány. Nežádoucí svodový proud prudce stoupá pod 2 nm díky tunelovému efektu. Použitím dielektrika s vysokým k lze tloušťku dielektrika opět zvýšit, aby se snížil svodový proud, aniž by došlo ke ztrátě výkonu tranzistoru (snížení spínací rychlosti). Silnější dielektrika tedy umožňují další miniaturizaci.
Ostatní sloučeniny hafnia
Karbid hafnia je jednou z látek s nejvyššími body tání. Spolu s nitridem hafnia a boridem hafnia je jedním z tvrdých materiálů.
Jsou známy některé halogenové sloučeniny hafnia. V oxidačním stavu + IV existují fluorid i chlorid, bromid a jodid. Chlorid hafnia (IV) a jodid hafnia (IV) hrají roli při výrobě hafnia. V nižších oxidačních stavech jsou známy pouze sloučeniny chloru a bromu a jodid hafnia (III).
Hexafluoridohafnát draselný (IV) K2[HFF6] a také hexafluoridohafnát amonný (IV) (NH4)2[HFF6] lze použít k oddělení hafnia od zirkonia, protože obě soli jsou rozpustnější než odpovídající komplexy zirkonia.
| Obvykle | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Jméno, symbol, atomové číslo | Hafnium, Hf, 72 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Serie | Přechodné kovy | ||||||||||||||||||||||||||||||||||||||||||||||||
| Skupina, období, blok | 4, 6, d | ||||||||||||||||||||||||||||||||||||||||||||||||
| vzhled | ocelově šedá | ||||||||||||||||||||||||||||||||||||||||||||||||
| číslo CAS | 7440-58-6 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Hmotnostní zlomek zemského pláště | 4,2 ppm | ||||||||||||||||||||||||||||||||||||||||||||||||
| jaderný | |||||||||||||||||||||||||||||||||||||||||||||||||
| atomová hmotnost | 178,49 u | ||||||||||||||||||||||||||||||||||||||||||||||||
| Atomový poloměr (vypočítaný) | 155 (208) hodin | ||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalentní poloměr | 150 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| elektronová konfigurace | [Xe] 4f14 5d2 6s2 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 1. ionizace | 658,5 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2. ionizace | 1440 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| 3. ionizace | 2250 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| 4. ionizace | 3216 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| fyzicky | |||||||||||||||||||||||||||||||||||||||||||||||||
| fyzický stav | fest | ||||||||||||||||||||||||||||||||||||||||||||||||
| modifikace | dva (a- / β-Hf) | ||||||||||||||||||||||||||||||||||||||||||||||||
| krystalová struktura | šestihranný | ||||||||||||||||||||||||||||||||||||||||||||||||
| hustota | 13,28 g / cm3 (25 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||
| tvrdost Mohs | 5,5 | ||||||||||||||||||||||||||||||||||||||||||||||||
| magnetismus | paramagnetické ( = 7,0 10-5) = 7,0 10-5) |
||||||||||||||||||||||||||||||||||||||||||||||||
| bod tání | 2506 K (2233 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||
| bod varu | 4876 K (4603 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Molární objem | 13,44 · 10-6 m3/ mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| Výparné teplo | 630 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| skupenské teplo tání | 25,5 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| tlak páry | 0,00013 Pa při 1970 K. | ||||||||||||||||||||||||||||||||||||||||||||||||
| Rychlost zvuku | 3010 m / s při 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||
| Měrná tepelná kapacita | 140 J / (kg · K) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrická vodivost | 3,12 · 106 A / (V · m) | ||||||||||||||||||||||||||||||||||||||||||||||||
| tepelná vodivost | 23 W / (m K) | ||||||||||||||||||||||||||||||||||||||||||||||||
| chemický | |||||||||||||||||||||||||||||||||||||||||||||||||
| oxidační stavy | 4 | ||||||||||||||||||||||||||||||||||||||||||||||||
| normální potenciál | -1,505 V (HfO2 + 4 H.+ + 4 e- → Hf + 2 H2O) |
||||||||||||||||||||||||||||||||||||||||||||||||
| electronegativity | 1,3 (Paulingova stupnice) | ||||||||||||||||||||||||||||||||||||||||||||||||
| izotop | |||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||
| vlastnosti NMR | |||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||
| bezpečnost | |||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||



