Křemík, Si, atomové číslo 14
Cena, výskyt, těžba a použití křemíku
Křemík, také křemík, je chemický prvek se symbolem Si a atomovým číslem 14. Je v 4u. Hlavní skupina (uhlíková skupina) nebo 14. IUPAC Group a 3. Období periodické tabulky prvků. Pokud jde o hmotnostní zlomek (ppmw), jedná se o druhý nejhojnější prvek v zemské skořápce po kyslíku.
Křemík je klasický polokov, proto má vlastnosti kovů i nekovů a je elementárním polovodičem. Čistý, elementární křemík má šedo-černou barvu a má typicky kovový, často bronzový až namodralý lesk.
Křemík je pro elektroniku nesmírně důležitý a protože 2018 v izotopově čisté formě slouží také pro definici kilogramu. Elementární křemík je pro lidské tělo netoxický, křemík ve vázané silikátové formě je pro člověka důležitý. Lidské tělo obsahuje asi 20 mg / kg tělesné hmotnosti křemíku; částka klesá s věkem.
Pravopis a etymologie
Ve výchozím nastavení je zapsán prvek „křemík“. Zápis s, c 'se používá hlavně v chemickém žargonu. Obě hláskování pocházejí z latinského termínu silicia, silica, spojený s latinským silexem „oblázek“, „rock“.
Anglické slovo pro křemík je křemík. Je zahrnuta například v názvu Silicon Valley. Příležitostně překládaný překlad silikonu je falešný přítel, protože silikony jsou třídou chemických sloučenin křemíku.
Historie
Použití v předindustriálním období
Sloučeniny křemíku, zejména horniny, tradičně hrály v lidské historii důležitou roli jako stavební materiál. Typickým příkladem rané kamenné struktury je Stonehenge. Dalším důležitým křemičitým materiálem, který se používá jako stavební materiál po dlouhou dobu, je hlinka, která byla původně používána při stavbě hlíny z větvených vláken, později ve formě cihel. Cement, který také obsahuje křemičitany, byl poprvé vyvinut Římany.
Kvůli jejich ostrým okrajům byly křemenné horniny také používány jako nástroje v době kamenné. Například Obsidian byl těžen jako zvláště vhodný nástrojový materiál v protohistorickém období a široce distribuován komerčně. Feuerstein byl těžen v oblastech křídou, jako je Belgie a Dánsko. Při extrakci kovů, zejména při výrobě oceli, se silikátová struska používá k ochraně kamen a pecí před vnikáním kyslíku a jako hlína nebo písek; možná byla objevena výroba skla.
Objev jako prvek
Poprvé v roce 1789 Antoine Lavoisier předpověděl, že Silex je oxid kovu. V roce 1807, Humphry Davy postuloval elektrochemické testy na přítomnost kovů křemík, hliník, zirkonium a glucinium (berylium).
"Kdybych měl takové štěstí, že jsem získal toto téma, a že jsem získal kovové látky, které jsem hledal, měl bych navrhnout jména křemíku, alumia, zirkonia a glukózy."
"Kdybych byl tak šťastný, že mám spolehlivější důkazy o tomto předmětu a že jsem učil kovové látky, které jsem hledal, navrhl bych jim jména křemíku, alumia, zirkonia a glukózy."
- Humphry Davy
V 1811, chemik Joseph Louis Gay-Lussac a Louis Jacques Thénard (viz Thénards Blau) produkovali nečistý a amorfní křemík (a-Si, nekrystalická, alotrópová forma křemíku). K tomu reagovali s fluoridem křemičitým s elementárním draslíkem. Podobný postup následoval Xnumx Jöns Jakob Berzelius ve Švédsku reakcí hexafluorokřemičitanu s elementárním draslíkem. Berzelius vyčistil výsledný amorfní křemík promytím. Byl prvním, kdo rozpoznal elementární povahu křemíku a pojmenoval ji.
Termín křemík je odvozen z latinského slova silex (oblázek, pazourek). Vyjadřuje, že křemík je běžnější v mnoha minerálech.
Anglický termín křemík byl navržen pro 1817 skotským chemikem Thomasem Thomsonem (1773-1852). Konec -on je určen k označení chemického vztahu k nekovovému uhlíku (uhlíku) a boru (boru).
První výroba čistého krystalického křemíku v roce 1854 byla následkem elektrolýzy nahrazena francouzským chemikem Henri Etienne Sainte-Claire Deville.
výskyt
Celá Země obsahuje asi 15 hmotnostních procent křemíku; zejména plášť je do značné míry složen z křemičitanových hornin. Zemská kůra je asi 25,8 hmotnostních procent křemíku; Díky tomu je po kyslíku druhým nejhojnějším chemickým prvkem. Zde se křemík vyskytuje v podstatě ve formě silikátových minerálů nebo jako čistý oxid křemičitý.
Písek tedy sestává hlavně z oxidu křemičitého. Křemen je čistý oxid křemičitý. Mnoho drahokamů je vyrobeno z oxidu křemičitého a více či méně příměsí jiných látek, jako je ametyst, růže a kouřový křemen, achát, jaspis a opál. Křemík vytváří silikáty s mnoha kovy. Příklady křemičitých hornin jsou slída, azbest, jíl, břidlice, živce a pískovec. Oceány také představují obrovský rezervoár křemíku: ve formě monomerní kyseliny křemičité se ve všech oceánech rozpustí ve značném množství. Celkem (od: 2011) jsou známé minerály křemíku 1437, přičemž vzácný moissanit s obsahem až 70% má nejvyšší obsah křemíku (pro srovnání: minerální křemen má obsah křemíku až 46,7%).
Protože křemík se vyskytuje v přírodě také v důstojné podobě, což je elementární forma, je Mezinárodní minerální asociací (IMA) uznávána jako minerál a je zařazena do Strunz'schenovy minerální klasifikace (vydání 9) pod systémem č. 1.CB.15 (vydání 8: I / B.05-10) vedl oddělení polokovů a nekovů. V převážně známé anglicky mluvící klasifikaci minerálů podle Dana prvek minerální nese systém č. 01.03.07.01.
V lokalitách 2011 byl detekován pevný křemík (15), a to i poprvé v depozitu Nuevo Potosí na Kubě. Další lokality jsou v Čínské lidové republice, Rusku, Turecku a Spojených státech.
Silicatkreislauf
Křemičité minerály jsou trvale degradovány reakcí s kyselinou uhličitou ve vodě za vzniku kyseliny metasiličité a uhličitanů, jak ukazuje příklad křemičitanu vápenatého:
Nerozpustná kyselina metasiličitá dále reaguje s kyselinou uhličitou za vzniku rozpustné kyseliny orthosilicové:
Kyselina ortosilicová však sama se sebou opět relativně rychle reaguje za vzniku (amorfního) oxidu křemičitého a vody za předpokladu, že hodnota pH je ≥ 3. Absolutní koncentrace kyseliny orthosilicic je relativně nízká (např. <Cca 7 mmol v mořské vodě).
Začlenění křemičitanu nebo silikátů rozpustných ve vodě do mořských organismů (1.), Které sedimentují po vymření po utopení nebo sopečným a magmatickým únikem na mořském dně, ustupují silikátové minerály (2.) A cyklus je uzavřen:
Časový horizont, ve kterém se tento proces odehrává, je několik milionů let, takže je podstatně delší než v případě uhlíkového cyklu živé přírody.
Křemík v živé přírodě
Kromě již zmiňované základní povahy křemíku existuje řada organismů, které produkují struktury obsahující oxid křemičitý. Nejznámější z nich jsou diatomy, houby (Porifera, Spongiaria) a radiolariany, které tvoří exoskelet z oxidu křemičitého enzymově katalyzovanou kondenzací kyseliny ortokřemičité Si (OH) 4. Mnoho rostlin také obsahuje siliku v jejich stoncích a listech. Známými příklady jsou zde přeslička a rostlina bambusu. Postavená páteřní křemík jim dává další stabilitu.
Fyziologický význam pro člověka
Zdá se, že křemík je potřebný pro tvorbu a zrání kostí. U telat vedlo podávání orthosilikátu k proliferaci kolagenu v kůži a chrupavce. Žádaný příjem odvozený z pokusů na zvířatech je 30 mg / d. Nedostatky u lidí dosud nejsou známy.
Silica nebo Silica terra jsou orální přípravky. V zásadě obsahují anhydridy kyseliny křemičité (oxid křemičitý) a říká se, že posilují pokožku, nehty, kosti a pojivovou tkáň a udržují je zdravé. Účinek nebyl vědecky prokázán.
Přebytek křemíku může způsobit hemolýzu erytrocytů a jako přímý důsledek změny buněk.
Extrakce v laboratoři
Elementární křemík lze získat v laboratorním měřítku redukcí, vycházející z oxidu křemičitého nebo tetrafluoridu křemičitého, s obecnými kovy. Reakce 2.) Je aluminotermický proces, který pracuje pouze s přidáním elementární síry, třetí cesta odpovídá objevu prvku:
Vysoce reaktivní amorfní křemík lze získat redukcí silicidů sodíkem nebo acidolýzou:
Těžba v průmyslu
Elementární křemík se používá v různých stupních čistoty v metalurgii (ferosilicium), fotovoltaice (solární články) a v mikroelektronice (polovodiče, počítačové čipy). V oboru je tedy běžné klasifikovat elementární křemík na základě různých stupňů čistoty. Rozlišuje se mezi simg (metalurgický stupeň, surový křemík, čistota 98-99%), sisg (solární stupeň, solární křemík, nečistoty menší než 0,01%) a vítězství (elektronický stupeň, polovodičový křemík, nečistoty malého 10-9). Pro solární články je čistota materiálu po celé jeho tloušťce důležitá pro zajištění co nejdelší možné životnosti nosiče, pro mnoho aplikací v mikroelektronice musí být vysoce čisté pouze vrchní vrstvy o velikosti 20 až 30.
Tradičně se používá proces Siemens, při kterém se křemík nejprve nechá reagovat s plynným chlorovodíkem při teplotě 300-350 ° C v reaktoru s fluidním ložem na trichlorsilan (silikcochloroform).
Po několika destilačních krocích se trichlorsilan tepelně rozkládá v přítomnosti vodíku při obrácení výše uvedené reakce na zahřátých silikonových tyčích s hyperplazií při 1000-1200 ° C. Na tyčích roste elementární křemík. Uvolněný chlorovodík se vrací do oběhu. Jako vedlejší produkt se vysráží chlorid křemičitý, který se buď převede na trichlorsilan a vrátí se do procesu nebo se spálí v kyslíkovém plameni na pyrogenní oxid křemičitý. Proces Siemens produkuje 19 kg odpadu a vedlejších produktů na kg křemíku hyperpure.
surový křemík
V průmyslovém měřítku se elementární křemík získává redukcí oxidu křemičitého uhlíkem v tavicí redukční peci při teplotách přibližně 2000 ° C. Výchozím materiálem je křemenný písek nebo křemenný štěrk.
2002 vyrobil asi 4,1 milionů tun tohoto průmyslového surového křemíku (Simg). Je dostatečně čistý pro metalurgické účely a používá se jako legující složka a deoxidant pro oceli (zlepšení korozní odolnosti, potlačení cementitu) a jako surovina pro výrobu silanu pomocí procesu Müller-Rochow, který nakonec slouží hlavně pro výrobu silikonů. Pro výrobu ferosilicia pro ocelářský průmysl (deoxidizér ve vysokopecním procesu) se následná reakce účelně provádí v přítomnosti elementárního železa.
Další možnosti trávení SiO2u jsou:
Trávení sodou při přibližně 1600 ° C v tavicí nádrži:
Hydrotermální digesce při přibližně 200 ° C vodou v autoklávu:
solární křemík
Pro výrobu solárních článků musí být surový křemík dále čištěn na sluneční křemík (Sisg). Existují různé postupy. Tyto metody jsou energeticky nejnáročnější součástí výroby solárních modulů díky mnoha složitým mezikrokům. Proto se nyní testují a používají různé výrobní metody, jako je metoda UMG (vylepšený metalurgický stupeň) a metoda FBR (reaktor s fluidním ložem).
Bezchlorovou alternativou je rozklad monosilanu, který se znovu rozkládá po čištění na zahřátých povrchech nebo při průchodu reaktory s fluidním ložem.
Takto získaný polykrystalický křemík (polysilikon) je vhodný pro výrobu solárních modulů a má čistotu vyšší než 99,99%. Ve sluneční technologii, stejně jako v mikroelektronice, jsou využívány polovodivé vlastnosti křemíku.
Pouze historický význam je postup, který dříve používala společnost DuPont. Bylo založeno na redukci tetrachlorchloranu elementárními zinkovými parami při teplotách 950 ° C.
Vzhledem k technickým problémům a velkému množství odpadu z chloridu zinečnatého se však tento proces dnes již nepoužívá.
polovodičové křemík
Monokrystalický polovodičový křemík
Pro aplikace v mikroelektronice je zapotřebí vysoce čistý monokrystalický křemík (Sieg). Zejména musí být kontaminace prvky, které jsou také vhodné jako dopingové prvky, sníženy na koncentrace pod určitými kritickými hodnotami tahem kelímku nebo roztavením zóny. Výrobce Shin-Etsu inzeruje "11N" -ref (= 99,999 999 999%) svých ingotů.
Při tažení kelímku (Czochralského proces) se solární křemík získaný v procesu Siemens roztaví v křemíkových kelímcích. Do této taveniny se umístí očkovací krystal monokrystalického křemíku o vysoké čistotě a pomalu se z taveniny vyjme, zatímco se točí krystalizací křemíku o vysoké čistotě v monokrystalické formě na krystalu, přičemž v tavenině zůstanou téměř všechny kontaminanty. Fyzickým pozadím tohoto procesu čištění je pokles teploty tání a tendence látek krystalizovat co nejčistší.
Alternativně se během tavení zóny pomocí elektrického indukčního ohřívače (prstencového tvaru) roztavená zóna vede křemíkovou tyčí, přičemž velká část kontaminantů se rozpustí v tavenině a migruje s ní.
Krystalický křemík o vysoké čistotě je v současné době nejvhodnějším základním materiálem pro mikroelektroniku; méně z hlediska svých elektrických vlastností než z důvodu chemických, fyzikálních a technických vlastností křemíku a jeho sloučenin (oxid křemičitý, nitrid křemíku atd.). Všechny běžné počítačové čipy, paměť, tranzistory atd. Používají jako výchozí materiál vysoce čistý křemík. Tyto aplikace jsou založeny na skutečnosti, že křemík je polovodič. Cíleným začleněním nečistot (dopingu), jako je indium, antimon, arsen, bor nebo fosfor, se elektrické vlastnosti křemíku mohou měnit v širokém rozmezí. Především pomocí takto generovaných efektů PN přechodů lze realizovat řadu elektronických obvodů. Vzhledem k rostoucímu významu elektronických obvodů se také mluví o věku křemíku. Název Silicon Valley pro high-tech region v Kalifornii také poukazuje na obrovský význam křemíku v polovodičovém a počítačovém průmyslu.
Amorfní křemík může být převeden na polykrystalický křemík pomocí excimerových laserů. To má rostoucí význam pro výrobu tenkovrstvých tranzistorů (TFT) pro ploché panelové displeje.
křemíkový plátek
Křemík je komerčně dostupný jak ve formě jemnozrnného prášku, tak ve větších kusech. Vysoce čistý křemík pro použití ve solárních modulech nebo v polovodičových součástkách se obvykle vyrábí ve formě tenkých disků monokrystalů, tzv. Křemíkových destiček (viz obr.). Vzhledem k vysokým počátečním investicím a dlouhým dobám výstavby potřebných pecí však jen málo společností na celém světě vyrábí surový křemík.
Největšími výrobci metalurgického křemíku jsou:
- Elkem (N, USA)
- Invensil (F, USA)
- Globe Metallurgical (USA)
- Rima Metal (Br)
Existuje asi dalších 15 dalších velkých producentů. V Čínské lidové republice existuje řada menších děl, což z ní činí největšího producenta v zemi.
Trh s polykrystalickým křemíkem a hyperpureem křemíkem se mění od poloviny 2000ů. Vzhledem k vysoké poptávce solárního průmyslu došlo ke ztrátě křemíku 2006.
Fyzikální vlastnosti
Křemík, stejně jako germanium, gallium, fosfor a antimon sousedící s periodickou tabulkou, je elementárním polovodičem. Energetická vzdálenost mezi valenčním pásmem a vodivým pásmem podle modelu pásu je 1,107 eV (při pokojové teplotě). Pomocí dopingu s vhodnými dopingovými prvky, jako je bor nebo arsen, lze vodivost zvýšit faktorem 106. U křemíku dotovaného tímto způsobem je přímka nečistot způsobená nečistotami a defekty mříže podstatně větší než přímka vnitřní linie, a proto se tyto materiály nazývají polovodiči nečistot. Parametr mřížky je 543 pm.
Spektrum komplexního indexu lomu (N = n + ik) křemíku
Komplexní index lomu, který závisí na vlnové délce světla, je zobrazen na sousedním obrázku. I zde lze číst informace o struktuře pásma. Silně rostoucí průběh extinkčního koeficientu k ukazuje přímý přechod pásma při 370 nm (E1 = 3,4 eV). Další přímý přechod v pásmu lze pozorovat při ≈ 300 nm (EΓ2 = 4,2 eV). Nepřímý přechod křemíku na pásmo (např. = 1,1 eV) lze pouze uhodnout. Skutečnost, že existují další nepřímé pásmové přechody, je vidět ze široké křivky k pro vlnové délky> 400 nm.
Stejně jako voda a několik dalších látek má křemík hustotu anomálie: její hustota v kapalné formě (při Tm = 1685 K) je o 10-11% vyšší než v pevné, krystalické formě (c-Si) u 300 K.
Chemické vlastnosti
Ve všech vyskytujících se v přírodě a ve velké většině synteticky vyráběných sloučenin tvoří křemík výhradně jednoduché vazby. Stabilita jednoduché vazby Si-O na rozdíl od dvojné vazby CO je způsobena jejím dílčím charakterem dvojité vazby, který je výsledkem překrývání osamělých párů kyslíku s prázdnými orbitaly křemíku. Pravidlo dvojné vazby, které je již dlouho považováno za platné, podle kterého je křemík prvkem 3. Mezitím se však stal zastaralým, protože je známo velké množství synteticky vyráběných sloučenin s Si-Si dvojnými vazbami. V 2004 byla strukturně charakterizována první sloučenina s formální trojitou vazbou Si-Si.
S výjimkou kyseliny fluorovodíkové obsahující kyselinu dusičnou (ve které se tvoří hexafluorokřemičitan) je křemík nerozpustný v kyselinách, protože k pasivaci dochází prostřednictvím tvorby pevné vrstvy oxidu křemičitého. Na druhé straně se snadno rozpouští v horkých louhových zásadách za vzniku vodíku. Přes svůj negativní normální potenciál (-0,81 V) je ve své kompaktní formě relativně inertní, protože se kryje ochrannou vrstvou oxidu ve vzduchu.
Mechanické vlastnosti
Mechanické vlastnosti křemíku jsou anizotropní (směrové). V závislosti na vybrané orientaci krystalu modul pružnosti předpokládá hodnoty mezi 130 GPa a 189 GPa. Obecný popis elastického chování je uveden ve Voigtově zápisu jako u všech kubických krystalů prostřednictvím tří nezávislých elastických konstant C11, C12 a C44. Matice elasticity je pro křemík:
Elastické konstanty mají následující hodnoty:
Příslušné moduly pružnosti lze vypočítat z elastických konstant pro jednotlivé hlavní směry krystalu křemíku (100,110 a 111):
izotop
Mezi 23Si a 22Si je známo celkem izotopů 45. Z nich jsou tři, izotopy 28Si, 29Si a 30Si, stabilní a přirozeně se vyskytující. Izotop s největším podílem přirozeného izotopového složení je 28Si s 92,223%, 29Si má podíl 4,685% a 30Si z 3,092%. Nejstabilnější nestabilní izotopy jsou 32Si, který přechází na 153P (fosfor) s poločasem 32 let při beta rozpadu, a 31Si, který se také rozkládá na 157,36P za beta rozpad s poločasem 31 minut. Všechny ostatní izotopy mají pouze krátké poločasy vteřin nebo milisekund.
28Si je tvořen v těžkých hvězdách ke konci jejich vývoje ve velkých množstvích (spalování kyslíku). To je důvod pro vysoký podíl 28Si v celkovém křemíku (92,23%) a také ve frekvenci křemíku ve srovnání s jinými prvky. Od 2009 byly učiněny pokusy předefinovat kilogram základní jednotky SI jako danou sadu atomů 28Si; tyto pokusy vedly 2018 k nové definici v listopadu. Rovněž stabilní jsou izotopy 29Si (4,67% podíl na celkovém křemíku) a 30Si (3,1%).
Radioaktivní izotop 31Si se rychle rozpadá (poločas 157,3 minut) beta zářením na stabilní fosfor. Tuto okolnost lze použít k produkci velmi homogenního n-dopovaného křemíku. Pro tento účel je křemík ozářen neutrony, přičemž neutronovým záchytem vzniká 31Si a tedy 31P. Vhodným zdrojem neutronů pro tuto metodu je výzkumný zdroj neutronů Heinz Maier-Leibnitz. Odolnější je 32Si s poločasem 172 let. Stopy tohoto izotopu se vytvářejí v zemské atmosféře spallací argonu kosmickým zářením. 32Si se rozkládá na stejně radioaktivní 32P (poločas 14,3 dnů) a poté na stabilní 32S (síra). Všechny ostatní izotopy se během několika sekund rozpadnou.
Sicherheit
Křemík je hořlavý prášek jako mnoho prvků. Jako prášek a granule to dráždí. Kompaktní křemík je neškodný.
Hydrogenovaný, tj. Povrchově vodíkem pokrytý, porézní křemík může být vysoce výbušný pod laserovým zářením a zvýšením kyslíku, jak vědci z technické univerzity v Mnichově objevili náhodou. Tryskání v rozsahu mikrometrů je možné. Rychlost detonace a detonační energie jsou vyšší než u TNT a dynamitu.
Použití v technologii
1947 objevil John Bardeen, Walter Brattain a William Shockley regulovatelný elektrický odpor, tranzistor, nejprve na germanium monokrystalu. Křemík radostný z připojení mohl být izolován teprve později v čistotě nutné pro elektronické účely. 1958 Robert Noyce ve Fairchildu a Jack S. Kilby v Texas Instruments nezávisle vyvinuli integrovaný obvod (IC) na křemíkovém čipu. Od roku 1970 je křemík základním materiálem většiny polovodičových výrobků a je základním materiálem pro mnoho senzorů a dalších mikromechanických systémů (např. Rameno páky v mikroskopu atomové síly). Křemík je také elementární součástí většiny solárních článků.
V listopadu byla společnost 2005 informována o prvních slibných výsledcích se silikonovými lasery.
Křemík se v mnoha výbušninách používá jako palivo s vysokou energií.
Protože křemík expanduje po ztuhnutí, zatímco většina látek se stahuje, přidává se k mnoha litým slitinám. Například litina vždy obsahuje asi 2% Si. Obzvláště důležité jsou slitiny hliník-křemík, ve kterých může být obsah Si až 20%. Toto je nejdůležitější paleta všech litých hliníkových materiálů.
Připojení
Křemík je téměř vždy čtyřmocný v chemických sloučeninách. Podle toho je atom křemíku ve sloučeninách obvykle čtyř souřadnic. Kromě toho existuje nyní řada sloučenin, ve kterých má křemík pět nebo šestinásobnou koordinaci. Kromě čtyřmocného křemíku a synteticky připravených sloučenin dvojmocného křemíku (silylenů) jsou známy, ale většina z nich je velmi nestabilní. Větší význam má pouze oxid křemičitý, který se používá jako materiál pro kompenzaci optických čoček. Kromě toho 2012 také experimentálně detekoval trojrozměrnou souřadnou sloučeninu podobnou jednorozměrné struktuře grafenu, tzv. Silicene.
Celá chemie křemíku je v podstatě charakterizována vysokou afinitou křemíku k kyslíku. Křemík je obvykle electropositive partner chemické sloučeniny, ačkoli tam jsou také sloučeniny s formally negoval křemík. Jedná se většinou o silicidy, kde křemík může také tvořit skutečné anionty.
![]()
Inverze vazebné polarity
Obzvláště pozoruhodné je obrácení polarity vazby vazby element-vodík při přechodu z uhlíku na křemík. Zde se rozdíl elektronegativity mění z + 0,45 (uhlík-vodík) na -0,2, a proto silanové sloučeniny mají zcela odlišnou reaktivitu než uhlovodíky.
Nejdůležitější sloučeniny křemíku lze rozdělit do následujících tříd, kterých se zmiňují někteří zástupci:
Binární spojení
- karbid křemíku
- křemen
- nitridu křemíku
- silicidy
silikátové
- Zirkon a všechny ostatní křemičitany a sloučeniny kyseliny křemičité
halogenidů křemíku
- Silicon fluorid
- chlorid křemičitý
- Trichlorosilan (silikcochloroform)
Silicon hydrides
- monosilan
- silany
Organické sloučeniny křemíku
- Tetramethylsilan (TMS, NMR standard)
- Methylchlorosilany, jako je dichlormethylsilan (stavební kameny pro silikony)
- phenylchlorosilane
- carbosilanes
- Carbosilazane
- karbosiloxanů
Polymerní sloučeniny křemíku
- Silikony (silikony, polyorganosiloxany) se vytvářejí polymerací a patří k nejdůležitějším průmyslovým plastům.
- Polymerní sloučeniny křemíku a kyslíku nacházejí uplatnění v mnoha oblastech; Slouží jako maziva a tmely v kosmetickém a stavebním průmyslu.
- Polysilany, -karbosilany, -karbosilazany, -karbosiloxany
ostatní
K tomuto dni, to je často případ, že anglické slovo “křemík” (pro křemík) je falešně přeložen nebo vyslovován v populárních vědeckých článcích nebo ve filmovém dabingu jako “silikon” (“silikon”). Stalo se to například v sci-fi seriálu Star Trek, thrilleri agenta Jamese Bonda tváří v tvář smrti nebo v animovaném seriálu Simpsonovi. Příklad: „Je životní forma vyrobena z uhlíku nebo silikonu?“
Ceny křemíku
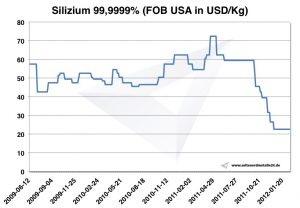
Graf křemíku 2009-2012





















