Molybden, Mo, atomové číslo 42
Cena molybdenu, historie, výskyt, těžba a použití
Molybden (řecky Μόλυβδος molybdos „Olovo“) je chemický prvek se symbolem prvku Mo a atomovým číslem 42. Je to jeden z přechodných kovů, v periodické tabulce je v 5. období a 6. podskupině (skupina 6) nebo chromové skupině.
Molybden, který se obvykle vyskytuje v ložiskách jako lesk molybdenu (disulfid molybdenu), byl dlouho zaměňován s leskem olova nebo grafitem. V roce 1778 se Carl Wilhelm Scheele podařilo proměnit lesk molybdenu na bílý oxid molybdeničitý (také oxid molybdeničitý) MoO zpracováním kyselinou dusičnou3 (Voda olověná země). V roce 1782 Peter Jacob Hjelm redukoval oxid na elementární molybden pomocí uhlí. Vzhledem ke své obtížné obrobitelnosti (čistý molybden může být plasticky deformován, ale kontaminace jednou desetitisícinou procenta kyslíku nebo dusíku činí molybden extrémně křehkým), byl molybden dlouho ignorován. Na konci 19. století si zaměstnanci francouzské společnosti Schneider & Co. všimli užitečných vlastností slitin molybdenu při výrobě pancéřových trubek. Ve dvou světových válkách byla poptávka po kovu velká, po druhé světové válce dramaticky poklesly ceny. Jediný západoevropský důl byl do roku 1973 provozován v norském Knabenu.
výskyt
Molybden většinou přichází jako molybdenit (lesk molybdenu, MoS2) s koncentrací asi 0,3%. Existuje také wulfenit (žlutá olověná ruda, PbMoO4) a Powellit Ca (Mo, W) O4. Vedlejší produkt molybdenit, který vzniká při těžbě mědi, se používá hlavně k tavení. MoS2-Koncentrát, který opouští doly ve směru „pražírny“, obsahuje přibližně 50–60% molybdenu. Velká ložiska se nacházejí ve Spojených státech, Chile, Číně, Kanadě a Peru. Světová produkce v roce 2007 činila 211.000 2006 tun (179.000 2007 62.000 tun). V roce 60.000 USA - jako největší producent - vyrobily 45.000 XNUMX tun, Čína XNUMX XNUMX tun a Chile XNUMX XNUMX tun.
Molybden v důstojné, tj. Elementární formě, lze zatím detekovat pouze ve čtyřech vzorcích (stav: 2011): na Zemi ve vzorku horniny ze sopky Korjakskaja Sopka na ruském poloostrově Kamčatka a ve třech vzorcích horniny z měsíce z vrchoviny Apollonius (Luna 20 ), Mare Crisium (Luna 24) a Mare Fecunditatis (Luna 16). Vzhledem k tomu, že objevy byly publikovány bez kontroly ze strany IMA / CNMNC, nebyl status molybdenu jako minerálu dosud potvrzen, i když minerální systém č. 1.AC.05 (na základě 9. vydání Strunzovy minerální systematiky).
Extrakce a prezentace
Většina molybdenu se získává jako vedlejší produkt při výrobě mědi a pouze přibližně 30% přímo z molybdenových rud. Všechny rudy se zpracovávají hlavně na heptamolybdenan amonný. To se vyrábí kalcinací při přibližně 400 ° C v oxidu molybdenu MoO3 odsouzený. Ten se redukuje na čistý prášek molybdenu ve dvou stupních za použití vodíku. První fáze vede k metastabilnímu hnědofialovému oxidu molybdeničitému MoO při 500–600 ° C2, druhý stupeň vede k čistému kovovému prášku při přibližně 1100 ° C. Lisování na kompaktní kov probíhá procesem HIP, přetavením v obloukové peci pod argonem jako ochranný plyn nebo v peci s elektronovým paprskem. Monokrystaly se vyrábějí zónovým tavením. Výtěžek molybdenu ze šrotu je téměř 100%, protože nedochází k žádným oxidačním ztrátám.



Eigenschaften
Molybden je přechodný kov z 5. období. Vysoce pevný, tvrdý a tvrdý kov má stříbřitě bílý lesk. Má nejvyšší teplotu tání ze všech prvků 5. období. Stejně jako těžký homologní wolfram není napaden redukujícími kyselinami (včetně kyseliny fluorovodíkové). Proto se molybden ve velkém množství používá k výrobě kyselinovzdorných nerezových ocelí a niklových materiálů. Oxidující kyseliny, jako je horká koncentrovaná kyselina sírová, kyselina dusičná nebo aqua regia, vedou k vysoké rychlosti odstraňování. Molybden je stejně nestabilní při oxidaci alkalických tavenin.
Verwendung
V malých přídavcích se používá k vytvrzení a zabránění popouštění křehnutí oceli. Více než dvě třetiny vyrobeného molybdenu se používají k výrobě kovových slitin, jako je feromolybden. Nedostatek wolframu v první světové válce vedl ke zvýšenému používání molybdenu pro výrobu vysoce pevných materiálů. Molybden je dodnes legujícím prvkem používaným ke zvýšení pevnosti, koroze a tepelné odolnosti. Vysoce výkonné materiály obsahující molybden, jako je Hastelloy®, Incoloy® nebo Nicrofer® Mnoho technických procesů to umožnilo nebo bylo ekonomicky rozumné.
Díky své vysoké teplotní odolnosti se molybden používá při výrobě dílů pro extrémní aplikace, jako je např B. používané v leteckém a metalurgickém průmyslu. Při zpracování oleje se používá jako katalyzátor k odstranění síry.
Díky své vrstevnaté struktuře je disulfid molybdeničitý ideálním mazivem, a to i při zvýšených teplotách. Může být použit jako pevná látka, jako je grafit, ale také suspendován v konvenčních mazacích olejích.
Molybden lze nalézt také v elektronických součástkách. V TFT (tenkovrstvé tranzistory) slouží jako vodivá kovová vrstva a také v tenkovrstvých solárních článcích se používá jako kovový zpětný vodič.
Molybdenové fólie slouží jako plynotěsné průchodky proudu v křemenném skle atd. A. na halogenových žárovkách a vysokotlakých plynových výbojkách.
Molybdát se používá k impregnaci tkanin, aby byly samozhášecí.
Molybden se také používá v rentgenové diagnostice jako cílový materiál v anodě. Rentgenové trubice s molybdenovou anodou se používají kvůli nižší energii charakteristických rentgenových paprsků (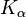 na 17,4 keV a
na 17,4 keV a 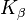 při 19,6 keV ve srovnání s 58 / 59,3 keV nebo 67,0 / 67,2 / 69,1 keV wolframu) molybdenu v. A. používá se při vyšetření ženského prsu (mamografii).
při 19,6 keV ve srovnání s 58 / 59,3 keV nebo 67,0 / 67,2 / 69,1 keV wolframu) molybdenu v. A. používá se při vyšetření ženského prsu (mamografii).
V nukleární medicíně se dělený molybden používá v generátorech technecia-99m. Relativně dlouhotrvající 99Mo (HWZ 66 h) se v rámci RNG rozpadá na 99mTc (technecium, poločas 6 h). Tímto způsobem lze tento důležitý izotop technecia získat přímo na místě pro výzkumné účely.
fyziologie

Bakteriální kofaktor molybdenu bis (molybdopterin-guaninový dinukleotid) molybden
Jako stopový prvek je molybden nezbytný pro téměř všechny živé organismy, protože je nezbytnou součástí aktivního centra řady enzymů, jako je dusičnanová, nitrátreduktázová a siřičitoxidáza. Živé bytosti používají enzymy obsahující molybden a podobně. A. pro rozklad purinů a tvorbu kyseliny močové. Biologicky dostupné, tj. H. formou molybdenu přijímaného organismy je molybdenanový ion MoO42-. To je začleněno do odpovídajících enzymů v několika krocích jako molybdenové kofaktory. Tam může atom Mo přepínat mezi koordinačními čísly + IV, + V a + VI a katalyzovat tak redoxní reakce s jedním elektronem.
Molybden je pro rostliny nezbytný. Nedostatek molybdenu může způsobit, že půda bude sterilní, což vysvětluje, proč hnojení heptamolybdenanem amonným zvyšuje výnos na těchto půdách. Koncentrace molybdenu v rostlinách a zvířatech je několik ppm. Molybden je velmi důležitý stopový prvek, zejména u luštěnin. Bakterie (nodulární bakterie) žijící v symbióze s luštěninami jsou schopny vázat atmosférický dusík s enzymem obsahujícím molybden (dusičnan). Molybden potřebujete pro dva procesy: fixaci molekulárního dusíku a redukci dusičnanů.
Molybden je také nezbytný pro lidskou výživu. Odhad DGE pro dospívající a dospělé předpokládá 50–100 µg molybdenu jako vhodný denní příjem. Nedostatek molybdenu se nevyskytuje. Pokud je dosaženo vysokého příjmu (10–15 mg / den) - například prostřednictvím půd bohatých na molybden, objeví se příznaky podobné dně, bolesti kloubů a zvětšení jater.
K deficitu kofaktoru molybdenu však dochází pouze jako dědičné onemocnění; jeden z enzymů, které katalyzují biosyntézu molybdenových kofaktorů, je mutován.
bezpečnost
Prach z molybdenu a sloučeniny, jako je oxid molybdeničitý a ve vodě rozpustné molybdenany, vykazují při vdechování nebo požití mírnou toxicitu.
Testy naznačují, že molybden má na rozdíl od mnoha jiných těžkých kovů relativně malou toxicitu. Akutní otravy jsou nepravděpodobné kvůli potřebným množstvím. V oblasti těžby a produkce molybdenu může dojít k vyšší expozici molybdenu. Doposud však nebyly známy žádné případy nemoci.
důkaz
Kvalitativní důkaz šestimocného molybdenu je možný vytvořením heteropolykyselin s fosfátem. Pokud se kyselina fosforečná přidá k roztoku obsahujícímu molybdenan obsahující kyselinu sírovou, vytvoří se krystalický gel molybdenu. Pokud se přidá mírné redukční činidlo kyselina askorbová, změní barvu na silně modrou (tvorba molybdenu modře). Při nižších koncentracích molybdenanu nedochází k srážení, pouze ke změně barvy roztoku.
![\ Mathrm {H_2PO_4 ^ - + 12 \ MoO_4 ^ {2-} + 6 \ H_3O ^ + + 3 \ NH_4 ^ + \ longrightarrow (NH_4) _3 [P (Mo_3O_ {12}) _ 4] (žlutá) + 10 \ H_2O }](https://upload.wikimedia.org/wikipedia/de/math/5/4/e/54e88a032d7745b68a3b0d7bc5907c31.png)
Tyto reakce se také používají pro fotometrické stanovení molybdenanu nebo fosfátu ve stopovém rozsahu. Alternativně lze molybden stanovit pomocí atomové spektrometrie. V polarografii poskytuje šestimocný molybden v kyselině sírové o koncentraci 0,5 mol / l dvě úrovně při -0,29 a -0,84 V (proti SCE). Je to způsobeno redukcí na Mo (V) nebo Mo (III).
| Obvykle | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Jméno, symbol, atomové číslo | Molybden, Mo, 42 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie | Přechodné kovy | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupina, období, blok | 6, 5, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| vzhled | šedá metalíza | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| číslo CAS | 7439-98-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hmotnostní zlomek zemského pláště | 14 ppm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| jaderný | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| atomová hmotnost | 95,94 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomový poloměr (vypočítaný) | 145 (190) hodin | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalentní poloměr | 154 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| elektronová konfigurace | [Kr] 4d5 5s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. ionizace | 684,3 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. ionizace | 1560 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. ionizace | 2618 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. ionizace | 4480 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| fyzicky | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| fyzický stav | fest | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| krystalová struktura | kubický na střed těla | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| hustota | 10,28 g / cm3 (20 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| tvrdost Mohs | 5,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| magnetismus | paramagnetické ( = 1,2 10-4) = 1,2 10-4) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| bod tání | 2896 K (2623 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| bod varu | 4912 K (4639 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molární objem | 9,38 · 10-6 m3/ mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Výparné teplo | 600 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| skupenské teplo tání | 36 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rychlost zvuku | 6190 m / s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrická vodivost | 18,2 · 106 A / (V · m) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| tepelná vodivost | 139 W / (m K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| chemický | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| oxidační stavy | 2, 3, 4, 5, 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| normální potenciál | -0,152 V (MoO2 + 4e- + 4H+ → Mo + 2 H2O) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| electronegativity | 2,16 (Paulingova stupnice) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| izotop | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| vlastnosti NMR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| bezpečnost | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ceny molybdenu
Cena molybdenu -> ceny pro strategické kovy

