Hořčík, Mg, atomové číslo 12
Cena hořčíku, historie, výskyt, extrakce a použití
Hořčík je chemický prvek se symbolem prvku Mg (Alchemy: ⚩) a atomovým číslem 12. V periodické tabulce prvků je ve druhé hlavní skupině nebo 2u. IUPAC patří do skupiny kovů alkalických zemin.
Hořčík je jedním z deseti nejčastějších prvků zemské kůry. Vyskytuje se v četných minerálech i v listové zeleni rostlin.
Historie
Původ označení prvku je v literatuře zobrazen odlišně:
- starořeckého μαγνησία λίθος znamenající „magnetický kámen“,
- Magnisia, oblast ve východním Řecku,
- z Magnesie, města v Malé Asii na území dnešního Turecka.
Zdá se však, že všechny zde uvedené derivace pocházejí etymologicky z magnetů nebo z jejich stejnojmenného Heros Magnes.
Sloučeniny hořčíku byly známé a používány po staletí před výrobou elementárního hořčíku. Magnesia alba označovala uhličitan hořečnatý, zatímco magnézia byla běžným názvem pro oxid hořečnatý.
Skotský fyzik a chemik Joseph Black byl první ze sloučenin hořčíku v 18u. Století systematicky zkoumáno. 1755 ve své práci De humore acido cibis orto et magnesia alba poznal rozdíl mezi vápnem (uhličitan vápenatý) a magnesia alba (uhličitan hořečnatý), které byly v té době často zaměněny. Vzal Magnesii albu jako uhličitan nového prvku. Protože toto, Black je často nazýván objevitelem hořčíku, ačkoli on nikdy reprezentoval elementární hořčík.
1808 získal sir Humphry Davy Magnesium-hydrid hořečnatý zvlhčený elektrolýzou pomocí kolony s popelem Volta - ne v čisté formě, ale jako amalgám, protože pracoval s katodou rtuti. Ukázal tedy, že Magnesia je oxidem nového kovu, který poprvé nazval Magnium.
Zahříváním suchého chloridu hořečnatého s draslíkem jako redukčním činidlem se 1828u podařilo vyrobit malá množství čistého hořčíku pro francouzského chemika Antoina Bussyho. 1833 byl první, kdo vyrobil hořčík elektrolýzou roztaveného chloridu hořečnatého. Na základě těchto experimentů německý chemik Robert Wilhelm Bunsen pracoval v 1840 a 1850 letech na procesech výroby hořčíku elektrolýzou roztavených solí pomocí Bunsenova prvku, který vyvinul. 1852 vyvinul elektrolytický článek, který produkoval větší množství hořčíku z roztaveného bezvodého chloridu hořečnatého. Tento postup je dnes výhodný pro získání hořčíku.
Technická výroba hořčíku začala ve Francii 1857 po postupu Henri Etienne Sainte-Claire Deville a H. Carona. Při tak zvaném procesu Deville-Caron se směs bezvodého chloridu hořečnatého a fluoridu vápenatého redukuje sodíkem. V Anglii začal Johnson Matthey vyrábět 1860 pomocí podobného procesu. Tyto počáteční podniky však zůstaly kvůli výrobním potížím neekonomické.
výskyt
Hořčík v přírodě neexistuje kvůli své reaktivitě v elementární formě. Jako minerál se vyskytuje převážně ve formě uhličitanů, křemičitanů, chloridů a síranů. Ve formě dolomitů je minerál hořčíku dokonce horský. B. v Dolomitech.
Nejdůležitějšími minerály jsou dolomit CaMg (CO3) 2, magnezit (hořkost) MgCO3, olivin (Mg, Fe) 2 [SiO4], enstatit MgSiO3 a kieserit MgSO4 · H2O.
Ostatní minerály jsou:
- Serpentin Mg3 [Si2O5] (OH) 4
- Mastek Mg3 [Si4O10] (OH) 2
- Sepiolit Mg4 [Si6O15] (OH) 2
- Schönit K2Mg (SOX NUMBER) 4 · 2 H6O
- Carnallite KMgCl3 · 6 H2O
- Spinel MgAl2O4
Když se rozpustí ve vodě, způsobuje spolu s vápníkem tvrdost vody. V mořské vodě je obsažen více než 1 kg / m3.
Extrakce a prezentace
K extrakci hořčíku dochází hlavně dvěma způsoby:
- Elektrolýzou roztaveného chloridu hořečnatého v buňkách Downs-Flow: Downsovy buňky sestávají z velkých žlabů železa, které jsou zahřívány zespodu. Jako anody slouží shora vložené grafitové tyče, které jsou obklopeny na špičkách prstencové katody. Kovový hořčík se hromadí na roztavené soli a odstraňuje se. Výsledný plynný chlor se shromažďuje v horní části článku a znovu se používá k výrobě chloridu hořečnatého z oxidu hořečnatého. Ke snížení teploty tání chloridu hořečnatého se k roztavené soli přidá chlorid vápenatý a chlorid sodný.
- Tepelnou redukcí oxidu hořečnatého (Pidgeonův proces): V nádobě vyrobené z chromniklové oceli se spálí dolomit, baryt a redukční činidlo, jako je ferosilicium. Potom se evakuuje (odčerpá se z plynu) a zahřeje se na 1160 ° C. Parní hořčík kondenzuje na vodou chlazené hlavové trubce mimo pec. Získaný hořčík se dále čistí vakuovou destilací.
Pidgeonův proces je dnes nejvýznamnějším výrobním procesem a používá se hlavně v Číně.
88% světové produkce hořčíku se odehrává v Číně, kde 2015 vyrobil přibližně 800.000 t hořčíku. Poté následuje jen několik procent každého podílu na trhu Rusko, Izrael a Kazachstán.
Produkce 1 kg hořčíku Pidgeonovým procesem produkuje skleníkové plyny s ekvivalentem CO2 asi 31 kg (pro srovnání: pro 1 kg oceli se tvoří ekvivalenty CO0,5 mezi 2 a 2 kg).
Přestože je hořčík obsažen ve více než minerálech 60, komerční význam má pouze dolomit, magnezit, brucit, karnallit, talek a olivin.
Kation Mg2 + je druhým nejhojnějším kationtem v mořské vodě, což činí z mořské vody a mořské soli atraktivní komerční zdroje hořčíku. K jeho extrakci se do mořské vody přidá hydroxid vápenatý za vzniku sraženiny hydroxidu hořečnatého.
Hydroxid hořečnatý (brucit) je nerozpustný ve vodě a může být odfiltrován a zreagován s kyselinou chlorovodíkovou za vzniku koncentrovaného chloridu hořečnatého.
Elektrolýza vytváří chlorid hořečnatý z chloridu hořečnatého.
Eigenschaften
Pevná stříbrná slitina hořčíku je asi o třetinu lehčí než hliník. Čistý hořčík má nízkou pevnost a tvrdost. Jeho modul je asi 45 GPa. Ve vzduchu je hořčík potažen vrstvou oxidu, která na rozdíl od hliníku není úplně neprůhledná. Důvodem je to, že oxid hořečnatý má nižší molární objem než samotný hořčík (MgO: 10,96 cm3 / mol, Mg: 13,96 cm3 / mol); s. Poměr Pilling-Bedworth.
Tenké proužky nebo fólie se snadno zapálí. Hoří na vzduchu s jasně bílým plamenem na oxid hořečnatý MgO a malý nitrid hořečnatý Mg3N2. Čerstvě vyrobený hořčíkový prášek se může zahřívat ve vzduchu, dokud se spontánně nezapálí. Nebezpečné reakce lze očekávat při vyšších teplotách, zejména s roztavenou kapalinou. Také v mnoha oxidech, jako je oxid uhelnatý, oxid dusičitý a oxid siřičitý, hoří hořčík.
Hořčík reaguje s vodou za vzniku vodíku:
Reakce hořčíku s vodou
To vytváří špatně rozpustný povlak hydroxidu hořečnatého, který do značné míry zastavuje reakci (pasivace). Dokonce i slabé kyseliny, jako jsou amonné soli, jsou dostatečné pro rozpuštění hydroxidové vrstvy, protože převádějí hydroxidové ionty na vodu a vytvářejí rozpustné soli. Bez pasivace exotermická reakce probíhá násilně; čím jemnější je hořčíkový prach, tím násilnější. Uvolněný vodík se vzduchem snadno vytvoří výbušnou směs (plynný kyslík).
Hořčík reaguje exotermicky s oxidem uhličitým za vzniku oxidu hořečnatého a uhlíku:
Reakce hořčíku s oxidem uhličitým
Oxid uhličitý proto nezhasíná hoření hořčíku, nýbrž je podporuje.
Na rozdíl od hliníku je relativně odolný vůči kyselině fluorovodíkové a zásadám. Důvodem je nízká rozpustnost fluoridu hořečnatého (MgF2), který zabraňuje další tvorbě iontů Mg (OH) 3.
izotop
Mezi 21Mg a 19Mg hořčíku je známo celkem izotopů 40. Z nich tři jsou izotopy 24Mg, 25Mg a 26Mg stabilní a vyskytují se v přírodě. Izotop s větším podílem přirozeného izotopového složení je 24Mg s 78,99%, 25Mg má podíl 10,0% a 26Mg 11,01%. Nejstabilnější nestabilní izotopy jsou 28Mg, který se mění na 20,915Al s poločasem 28 hodin při beta rozpadu, a 27Mg, který se také rozkládá na 9,435Al s poločasem 27 minut pod beta rozpadem. Všechny ostatní izotopy mají pouze krátké poločasy vteřin nebo milisekund.
Verwendung
Kovový hořčík
Hořčík a drát se používá v zápalných zařízeních, bombách a lehké munici, dříve také jako bleskový prášek. Hořčíkové tyčinky často fungují jako obětní anody chránící části vzácnějších kovů před korozí.
V metalurgii najde hořčík všestranné použití,
- jako redukční činidlo v procesu Kroll pro získání titanu,
- jako redukční činidlo pro regeneraci uranu, mědi, niklu, chrómu a zirkonia,
- jako součást hliníkových slitin skupin AlSiMg a AlMg,
- jako hořčíkové granule pro odsiřování železa a oceli,
- jako agregát pro tvárnou litinu,
- jako základ skupiny standardizovaných lehkých slitin pro konstrukci letadel a motorových vozidel (tyto taveniny vyžadují krycí vrstvu roztaveného chloridu hořečnatého pro ochranu proti vniknutí vzduchu a oxidaci, viz ošetření tavením),
- jako palivo pro hořáky, které hoří pod vodou.
V organické chemii se používá k výrobě Grignardových sloučenin.
Protože hořčík se velmi snadno vznítí, používá se také jako velmi robustní zapalovač. Tyto hořčíkové bloky, prodávané jako Fire Starter Kits, mají na jedné straně tyč, jejíž oděr se spontánně vznítí ve vzduchu, jako pazourek zapalovače. Procedura je velmi podobná metodě pálení kamínků a škváry v době kamenné, přičemž roli škváry hraje hořčík. Nejprve se kousky seškrábnou z hořčíkového bloku nožem a umístí se na nebo pod skutečné palivo. Poté, seškrábáním na záda, se vytvoří „pazourek“ (např. Zadní stranou nože) jiskry co nejblíže k hořčíkovým odbočkám, aby je zapálily.
slitiny hořčíku
Nejdůležitější vlastností slitin hořčíku, díky nimž jsou důležitější než hliník a jeho slitiny, je lehká konstrukce, kterou umožňují. S hustotou kolem 1,75 g / cm³ je rozdíl oproti hliníkové lehké konstrukci s hustotou 2,75 g / cm³ jasný. Kromě toho je rozsah tání mezi 430 a 630 ° C, tj. Nižší spotřeba energie. Mechanické vlastnosti, jako je pevnost v tahu a tvrdost, jsou však výrazně nižší než u hliníkových slitin. Díky nízké hustotě byl hořčík brzy zajímavý pro mobilní aplikace. První významná aplikace se uskutečnila před první světovou válkou při stavbě lešení pro pevné vzducholodi Zeppelin. V automobilech byly slitiny hořčíku použity k výrobě částí karoserií a ráfků pro všechny druhy mobilních aplikací. 1930 stále častěji používá slitiny hořčíku v konstrukci letadel kvůli úsporám na hmotnosti, energeticky účinnějším letům a vyššímu užitečnému zatížení. To vše vedlo k rychlému rozšíření výroby hořčíku v Německu (Elektron z chemické továrny Griesheim) a po 1940 také v USA. "Elektron" se stal ochrannou známkou pro první slitiny hořčíku ihned po zahájení výroby.
Jiná použití pro odlévání hořčíku se nabídla v průběhu technického vývoje, částečně s válkou, částečně konstruktivním výhledem do budoucnosti a současně optimalizací slitin. Jako materiály na bázi hořčíku byly vyvinuty slitiny Mg-Al, Mg-Mn, Mg-Si, Mg-Zn a nakonec slitiny Mg-Al-Zn.
Převodovka VW Beetle byla odlita v milionech vrstev slitiny Mg-Si. Dnes se slitiny hořčíku používají nejen z hlediska úspory hmotnosti, ale vyznačují se také vysokým útlumem. To vede ke snížení vibrací a emisí hluku při vystavení vibracím. I z tohoto důvodu se slitiny hořčíku staly zajímavými materiály v konstrukci motorů, například v automobilovém průmyslu. Takže nejen části motoru jsou vyrobeny ze slitiny hořčíku, ale stále častěji také pro lití bloků motoru, hybridní metoda / hybridní lití se poprvé uplatnilo v sériové výrobě v Alfa Romeo 156, později také v BMW (viz také BMW N52).
Při tlakovém lití (viz také pod formováním) může být mnoho, dokonce velkých, tenkostěnných součástí blízkých konečným rozměrům a vyrábět bez nákladného přepracování, jako je. Jako ráfky, profily, skříně, dveře, kapoty, bootl, páka ruční brzdy a další. Nejen v automobilovém průmyslu, ale také ve strojírenství je konstruován s částmi slitin Mg-Al-Zn.
Úsilí o lehkou konstrukci již vedlo ke konci 20. K slitinám hořčíku a lithia, ještě lehčí slitiny hořčíku s přídavkem lithia.
Hořčík v medicíně
Nedávný výzkum slibuje vysoký vývojový potenciál hořčíkových materiálů jako resorbovatelného implantátového materiálu (např. Jako stentu) pro lidské tělo. Hořčík musí být při aplikaci chráněn proti kontaktní korozi. Odolnost proti korozi vůči normálním atmosférickým vlivům je však dobrá. Chování při kontaktní korozi by bylo rozhodující výhodou při použití jako dočasně omezeného materiálu implantátu, protože by se po určité době bezpečně rozpustilo. To eliminovalo rizika a náklady na chirurgický výkon odstranění implantátu.
umělé hnojivo
Při vápnění orných a travních ploch se hořčík ve formě oxidu hořečnatého nebo uhličitanu hořečnatého používá k vyrovnání vyčerpání hořčíku v půdě rostlinami. Dále se zvyšuje pH půdy a zlepšuje se dostupnost dalších živin. Zde se sloučenina hořčíku obvykle používá společně s vápnem jako komplexní hnojivo obsahující hořčík a vápník. Jako komplexní hnojivo se používá přirozeně se vyskytující jako Bobierrit fosforečnan hořečnatý Mg3 (PO4) 2 (trimagnesium fosfát) a dusičnan hořečnatý.
fyziologie
Hořčík je jednou ze základních látek, a je proto nezbytný pro všechny organismy. V listové zeleni rostlin je chlorofyl, hořčík, obsažen přibližně v 2%. Tam tvoří centrální atom chlorofylu. U rostlin s nedostatkem hořčíku hibernace i nedostatek světla. Také hořčík lidského těla musí být dodáván denně v dostatečném množství, aby se zabránilo nedostatku hořčíku.
Tělo dospělého obsahuje asi 20 g hořčíku (pro srovnání: 1000 g vápníku). V krevní plazmě se hořčík váže na 40% proteinů; normální hladina séra je 0,8-1,1 mmol / l. Hořčík se účastní některých enzymatických reakcí 300 jako enzymatická složka nebo koenzym. Volné ionty Mg navíc ovlivňují potenciál buněčných membrán a působí jako druhé posly v imunitním systému. Stabilizují klidový potenciál excitovatelných svalových a nervových buněk a buněk autonomního nervového systému. Nedostatek hořčíku způsobuje neklid, nervozitu, podrážděnost, nedostatek koncentrace, únavu, celkový pocit slabosti, bolesti hlavy, srdeční arytmie a svalové křeče. Může také dojít k infarktu. V oblasti metabolismu a psychiky se předpokládá, že nedostatek hořčíku zhoršuje depresi a schizofrenickou psychózu. Nadbytek hořčíku v krvi může nastat v důsledku nadměrného příjmu a renální dysfunkce a vede k poruchám nervového systému a srdce.
K resorpci hořčíku dochází nejprve v horní části tenkého střeva, ale také ve zbytku zažívacího traktu. Vylučuje se ledvinami a je přítomen v různých množstvích ve všech potravinách i v pitné vodě. Požadovaná denní dávka asi 300 mg se obvykle dosáhne dobře vyváženou stravou. Zvýšená potřeba může být pokryta doplňky nebo léky. Mírný nedostatek hořčíku je možný kvůli vážným nemocem, těhotenství nebo konkurenčním sportům. Závažné nedostatky se vyskytují při renální dysfunkci, dlouhodobém průjmu, chronickém zánětu střev, špatně kontrolovaném diabetu mellitu, kortikosteroidech, některých diuretikách nebo alkoholismu s podvýživou.
Soli hořčíku, jako je citrát, glukonát, aspartát a aspartát hydrochlorid, jsou v Německu schváleny jako léčiva v denních dávkách 100 až 400 mg proti stavům nedostatku a nervosvalovým poruchám, jako jsou svalové křeče, migréna nebo těhotenské komplikace. Mezi vedlejší účinky patří gastrointestinální diskomfort a průjem, předávkování také zpomaluje únavu a puls. Kontraindikace zahrnují renální dysfunkci a určité srdeční arytmie.
Pro perorální příjem doplňků hořčíku (tablet, žvýkacích nebo pastilek, granulí pro rozpuštění v tekutině) je na jedné straně důležité dávkování. Několik studií dospělo k závěru, že při užívání přípravku 120 mg je absorbováno přibližně 35%, ale při užívání úplné denní dávky přípravku 360 mg je absorbováno pouze přibližně 18%. Pro absorpci v těle není forma sloučenin používaných dnes v lécích irelevantní, protože jsou farmakologicky i biologicky a klinicky ekvivalentní; Organické soli, jako je aspartát hořečnatý nebo citrát hořečnatý, jsou v těle absorbovány pouze rychleji než anorganické sloučeniny. Na druhé straně, další hořčík zůstává v těle prospěšný, pouze pokud je v těle k dispozici dostatečné množství vazebných molekul; To se provádí biochemickými úpravami pouze po dlouhodobém zvýšení dodávky nebo příjmu hořčíku po dobu nejméně čtyř týdnů. Sulfát hořečnatý („Epsomova sůl“) byl dříve používán jako projímadlo. Soli hořčíku se používají v alternativní medicíně.
Jídlo
Hořčík slouží jako kofaktor různých proteinů 300, zejména enzymů vázajících ATP a nukleové kyseliny. Doporučený denní příjem hořčíku u lidí je v závislosti na věku a pohlaví mezi 24 a 400 mg denně.
Hořčík se používá jako složka v mnoha potravinách, zejména v celozrnných výrobcích (například celozrnný chléb, celozrnné těstoviny, celozrnná rýže, ovesné vločky, kukuřičné lupínky), minerální voda, zejména léčivá voda, voda z kohoutku s dostatečnou tvrdostí vody, játra, drůbež, ryby, dýňová semínka, slunečnicová semínka, čokoláda , Kešu ořechy, arašídy, brambory, špenát, kedluben, bobule, pomeranče, banány, sezam, sirup z cukrové řepy, mléko a mléčné výrobky.
Nebezpečí a ochranná opatření
Nebezpečí elementárního hořčíku do značné míry závisí na teplotě a velikosti částic: kompaktní hořčík je bezpečný při teplotách pod bodem tání, zatímco hořčíky a prášky jsou vysoce hořlavé. Díky velkému povrchu může snadno reagovat s kyslíkem ve vzduchu. U velmi jemného hořčíku je nebezpečí samovznícení; Směsi vzduch-prášek jsou dokonce výbušné. Flegmatizace je ošetření snižující nebezpečí při zpracování hořčíku, jako jsou kovové prášky obecně. Roztavený hořčík se také spontánně vznítí ve vzduchu. I s mnoha dalšími látkami, jako je voda a jiné sloučeniny obsahující kyslík, reaguje jemnozrnný nebo zahřátý hořčík. Taveniny hořčíku proto vyžadují trvalou ochranu proti vniknutí atmosférického kyslíku. V praxi se to provádí zakrytím taveniny pomocí činidel bohatých na chlorid hořečnatý. Jako ochrana proti oxidaci je také vhodný hexafluorid sírový. Dříve obvyklé potahování elementární sírou se již nepraktikuje kvůli silné nepříjemnosti způsobené oxidem siřičitým.
Při požáru hořčíku dochází k teplotám až přibližně 3000 ° C. Za žádných okolností nesmí být používána běžná hasiva, jako je voda, oxid uhličitý, pěna nebo dusík, protože hořčík s nimi prudce reaguje. Když voda vstoupí do hořčíku, existuje akutní nebezpečí oxyhydrogenové reakce.
Pro oheň (kovové ohně) taveniny platí hasicí princip udusení, tj. Rychlé vytlačení kyslíku. V nejjednodušším případě potažením suchým pískem, jinak nanesením potahové soli na taveniny hořčíku. Hasicí prášek požární třídy D, magnéziový prášek (magnesia usta / spálená magnézia), v případě potřeby jsou vhodné také suché ricinové třísky z nerezavějící šedé.
Při použití hořčíku je proto nutné přesně dodržovat všechny uvedené bezpečnostní pokyny. V žádném případě by nemělo být vytvářeno výbušné prostředí (hořčík, vodík, aerosoly a páry hořlavých chladicích maziv). Rovněž je třeba dodržovat běžná bezpečnostní opatření, jako je prevence zdrojů zapálení.
důkaz
Nejlepší způsob, jak zjistit hořčík, je Magneson II, Titangelb nebo Chinalizarin.
Pro detekci pomocí Magnesonu II (4- (4-nitrofenylazo) -1-naftol) se zásobní látka rozpustí ve vodě a zalkalizuje se. Poté se přidá několik kapek roztoku azofarbiva Magneson II. V přítomnosti iontů hořčíku se vytvoří tmavě modré zbarvené jezero. Ostatní kovy alkalických zemin by měly být dříve odstraněny srážením jako uhličitany.
Pro detekci pomocí Titangelbu (Thiazolgelb G) se zásobní látka rozpustí ve vodě a okyselí. Poté se smísí s kapkou roztoku Titangelbu a zalkalizuje se zředěným roztokem hydroxidu sodného. Přítomnost hořčíku vytváří jasně červenou sraženinu. Nikl, zinek, mangan a kobaltové ionty interferují s touto detekcí a měly by být nejprve vysráženy jako sulfidy.
Pro detekci s chinalizarinem je roztok vzorku kyseliny smíchán se dvěma kapkami barvicího roztoku. Poté se přidává zředěný roztok hydroxidu sodného až do zásadité reakce. Modré skvrny nebo sraženiny indikují hořčík.
Jako detekční reakce pro hořečnaté soli a tvorbu sraženin lze použít s roztoky fosfátových solí. Roztok vzorku neobsahujícího těžký kov s amoniakem a chloridem amonným až do pH 8 do 9 pufrovaného vzorku se přidá roztokem hydrogenfosforečnanu sodného. Bílá zákal rozpustný v kyselině způsobený fosforečnanem amonným a MgNH4PO4 označuje ionty hořčíku:
Z roztoku amoniaku lze Mg2 + detekovat také oxinem jako slabě rozpustnou žlutozelenou sloučeninu. Tento důkaz je vhodný pro proces separace kationtů.
Připojení
Ve sloučeninách se hořčík vyskytuje téměř výhradně jako dvojmocný kation s oxidačním stavem 2.
Oxidy a hydroxidy
Oxid hořečnatý (hořčík) tvoří bezbarvé krystaly ve struktuře chloridu sodného. V přírodě se vyskytuje jako vulkanický minerální periclas. Jsou bílé až šedé, inkluze také tmavě zelené, lesklé sklovité pravidelné krystaly. Přidává se do potravin jako regulátor kyselosti nebo uvolňovací činidlo a má také různé inženýrské aplikace v laboratořích a v průmyslu. V medicíně se používá pro substituční terapii.
Hydroxid hořečnatý je bezbarvá silně bazická sůl, která se přirozeně vyskytuje jako minerální brucit. Má trigonální krystalovou strukturu v prostorové skupině P3m1 (pokojová skupina č. 164) a používá se jako jedlá olejová aditiva (pro stanovení oxidu siřičitého), jako flokulant pro čištění odpadních vod, jako retardér hoření v termoplastech (polyolefiny, polyvinylchlorid) a elastomery a jako aditiva v čisticích prostředcích použity. V medicíně se používá jako antacidum pro neutralizaci žaludeční kyseliny a jako mírné projímadlo.
Peroxid hořečnatý je jemně prášková bezbarvá sloučenina, která má strukturu pyritových krystalů ve skupině prostorů Pa3 (číslo skupiny prostorů 205). Připomíná peroxid vápníku a uvolňuje kyslík řízenou reakcí s vodnými roztoky. Má různé aplikace v zemědělství, farmacii a kosmetice.
halogenidy
Chlorid hořečnatý je vysoce hygroskopický a vyskytuje se v přírodě v minerálním bishopitu (MgCl2 · 6 H2O), jako dvojitý solný karnallit (KMgCl3 · 6 H2O), v mořské vodě a ve slaných jezerech. Krystalizuje v trigonálním krystalovém systému ve skupině prostorů R3m (číslo skupiny prostorů 166). V potravinářské technologii se používá jako regulátor kyselosti, konsolidátor, zvýrazňovač chuti, nosič nebo uvolňovací činidlo. Hexahydrát chloridu hořečnatého jako tepelná baterie může ukládat a uvolňovat tepelnou energii.
Fluorid hořečnatý tvoří bezbarvé krystaly, které krystalizují tetragonálně ve struktuře rutilu ve vesmírné skupině P42 / mnm (číslo vesmírné skupiny 136). Díky svým optickým vlastnostem a chemické stabilitě je důležitým materiálem pro optické aplikace.
Bromid hořečnatý a jodid hořečnatý jsou také hygroskopické soli, které mají trigonální krystalovou strukturu v prostorové skupině P3m1 (číslo prostorové skupiny 164).
Ostatní anorganické sloučeniny
Uhličitan hořečnatý se v přírodě vyskytuje ve velkých množstvích jako magnezit (hořký). Krystalizuje trigonal ve skupině prostorů R3c (číslo skupiny prostorů 167). V potravinářském průmyslu se přidává jako regulátor kyselosti, nosič nebo uvolňovací činidlo. Používá se pro lezení a gymnastiku a je také znám jako Magnesia a Chalk. Před zahájením tréninku se sportovci sami suší v dlaních tak, že jejich kůže nedrží příliš pevně, když uchopí tyče nebo železné tyče vodorovné tyče nebo činky. Má také lékařské a průmyslové aplikace.
Dusičnan hořečnatý je bezbarvá hygroskopická sůl, která je snadno rozpustná ve vodě. Hexahydrát (Mg (NO3) 2.6 H2O) má monoklinickou krystalovou strukturu s prostorovou skupinou P21 / c (číslo prostorové skupiny 14). Používá se jako hnojivo, skladování latentního tepla (jako hexahydrát) nebo v keramickém průmyslu.
Heptahydrát síranu hořečnatého (Mg (SO4) · 7 H2O) je známý jako minerální Epsomit. Tvoří bezbarvé krystaly, které tvoří kosočtverečnou pseudotetragonální krystalovou mřížku. Krystaly často kvetou ve vláknitých agregátech a vytvářejí stalaktity. Používá se pro hnojiva, jako sušicí prostředek a pro lékařské použití.
Fosforečnany hořečnaté (dihydrogenfosforečnan hořečnatý (Mg (H2PO4) 2), hydrogenfosforečnan hořečnatý (MgHPO4) a fosforečnan hořečnatý (Mg3 (PO4) 2)) se v průmyslu používají jako keramická surovina a jako samozhášecí přísada. V potravinářském průmyslu se používají jako doplňková látka, projímadlo a potravinářská přídatná látka. Potraviny se přidávají jako regulátor kyselosti nebo uvolňovací činidlo.
Spinel je často se vyskytující minerál z minerální třídy oxidů a hydroxidů s idealizovaným chemickým složením MgAl2O4, a je tedy chemicky hlinitan hořečnatý. Krystalizuje izotypicky s magnetitem v systému krychlových krystalů ve skupině prostorů Fd3m (číslo skupiny prostorů 227).
Dolomit je velmi běžný minerál z minerální třídy uhličitanů a dusičnanů s chemickým složením CaMg [CO3] 2, a je tedy chemicky uhličitan vápenatý a hořečnatý. Krystalizuje v trigonálním krystalovém systému ve skupině prostorů R3 (číslo skupiny prostorů 148).
Jako zásobník vodíku a energie lze použít hydrid hořečnatý. Vodík uvolňovaný z hydridu hořečnatého může produkovat kovovou pěnu se zajímavými vlastnostmi, která je lehčí než voda.
Mezi další zajímavé krystalické sloučeniny hořčíku patří například diborid hořečnatý, karbid hořečnatý, nitrid hořečnatý, sulfid hořečnatý, silicid hořečnatý, germanid hořečnatý, metakřemičitan hořečnatý, oxid titaničitý hořečnatý a polonid hořečnatý.
organohořečnaté
Organanyly hořčíku jsou organokovové sloučeniny, ve kterých existuje vazba mezi hořčíkem a uhlíkem. Mezi organicky hořečnatými Grignardovými sloučeninami (R-Mg-X) jsou zdaleka nejdůležitější. Binární hořčíkové organyly a alkenylmagnesiumhalogenidy hrají významně podřízenou roli.
Organylmagnesiumhalogenide
Organylmagnesiumhalogenidy (obvykle nazývané Grignardova sloučenina) se získávají přímým způsobem reakcí organylhalogenidů s hořčíkovými hoblinami. Grignardovy sloučeniny jsou v roztoku ve Schlenkově rovnováze. Reagují za substitucí halogen-organyl na elementární organyly:
obecně platí:
z. Například:
nebo přidáním organylů s více vazebnými systémy:
obecně platí:
z. B.:
Binární hořčíkové organyly (R2Mg, také nazývané diorganyly hořčíku) lze vyrábět různými způsoby:
transmetalací, například rtuťového diorganylenu:
demutací v posunu Schlenkovy rovnováhy pomocí 1,4-dioxanu:
Magnesacycles (cyklické alkany s hořčíkem v kruhu) mohou být také připraveny s 1,4 dioxanem.
metathezí Grignardových sloučenin s lithium organyly
hydromagnesizací (přidání MgH2 k 1-alkenům):
přidáním elementárního hořčíku k dvojitým vazbám C = C v některých nenasycených uhlovodících, jako je 1,3-butadien nebo anthracen (přidání kovu). Například je možná reakce 1,3-butadienu v tetrahydrofuranu při pokojové teplotě:

Produkovaný butadien hořečnatý, také nazývaný (2-buten-1,4-diyl) hořčík, může sloužit jako zdroj butadienových aniontů v dalších syntézách. Podobně je znázorněn oranžově-žlutý anthracen hořečnatý. Anthracen hořečnatý může být potom použit jako katalyzátor pro hydrogenaci hořčíku.
alkenylmagnesium
Alkyny reagují s alkeny za vzniku alkenylmagnesiumhalogenidů v průběhu takzvané karbomagnesace:

Ostatní organické sloučeniny
Hydrogencitrát hořečnatý a trimagnesiumdicitrát jsou hořečnaté soli kyseliny citronové. Citrát hořečnatý se používá jako léčivo.
Monoperoxyftalát hořečnatý je dezinfekční prostředek pro povrchovou dezinfekci.
Stearan hořečnatý je hořečnatá sůl kyseliny stearové a patří do vápenných mýdel. Skládá se z jednoho iontu hořčíku a dvou stearátů s dlouhým řetězcem.
Cena hořčíku
Ceny hořčíku -> ceny strategických kovů
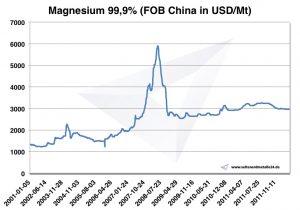
Graf Hořčík 2001-2011













