Germanium, Ge, atomové číslo 32
Germanium cena, výskyt, těžba, použití
Germanium (z latinské Germánie „Německo“, po zemi, ve které bylo poprvé nalezeno) je chemický prvek se symbolem Ge a atomovým číslem 32. V periodické tabulce je v 4. Období a v 4. Hlavní skupina (14, IUPAC skupina, p-blok a uhlíková skupina). Bylo to na 6u. Únor 1886 poprvé detekován v minerálním argyroditu.
Historie
Když Xnumx Dmitri Mendeleev navrhl periodickou tabulku, objevil mezeru pod křemíkem a předpokládal dosud neznámý prvek, který nazval Eka křemík. Mendeleev předpovídal vlastnosti Eka-křemíku a jeho sloučenin, které však věda odmítla.
1885 zjistil, že Clemens Winkler (1838-1904), chemik ve společnosti Bergakademie Freiberg při práci s nově objeveným minerálním argyroditem, že jeho kvantitativní analýza vždy dosáhla schodku kolem sedmi procent. Jak často se analýza opakovala, schodek zůstal přibližně konstantní a Winkler nakonec hádal, že minerál obsahoval dosud neznámý prvek. Po čtyřech měsících práce nakonec uspěl v 6. Únor 1886 izolace sraženiny bílého sulfidu, kterou lze v proudu vodíku redukovat na kovový prášek. Po dříve objevené planetě Neptun chtěl Winkler zpočátku nazvat nový prvek Neptunium. Protože toto jméno už bylo použito pro další podezřelý prvek, pojmenoval ho po objevu Germanium. Winkler nejprve navrhl, že Germanium byl Eka stibium postuloval Mendeleev, zatímco Mendeleev zpočátku chtěl klasifikovat to jako Eka kadmium spíše než Eka křemík. Po stanovení dalších vlastností bylo potvrzeno, že to byl pravděpodobně předpovězený prvek Eka-křemík. Mendeleev odvozil své vlastnosti ze své periodické tabulky, takže tento nález přispěl k uznání periodické tabulky:
Původ a etymologie názvu germanium by mohly pramenit také ze sémantického nedorozumění v souvislosti s jeho předchůdcem element gallium, protože existují dvě teorie pojmenování gallium. Po prvním, francouzský chemik Paul Émile Lecoq de Boisbaudran pojmenoval prvek po Gaulu, latinském jménu jeho rodné Francie. Druhým je latinské slovo gallus (cock) jako zdroj názvu, což ve francouzštině znamená le coq („cock“). Paul Émile Lecoq de Boisbaudran by nový prvek pojmenoval podle svého vlastního jména. Winkler předpokládal, že předchozí prvek Gallium byl pojmenován po národnosti francouzského průzkumníka. Takže na počest své země nazval nový chemický prvek „Germanium“ (Latinská Germánie pro Německo).
výskyt
Germanium je rozšířené, ale vyskytuje se pouze ve velmi nízkých koncentracích; Hodnota Clarke (= průměrný obsah v zemské kůře): 1,5 g / t. V přírodě se obvykle vyskytuje jako sulfid (thiogermanát) a často se vyskytuje jako společník v měděných a zinkových rudách (měděná břidlice Mansfeld). Nejdůležitějšími minerály jsou argyrodit 

Těžba a výroba
Podle USGS byla roční produkce 2014 odhadována na 165 t, z toho 120 t byl v Číně. Cena za 1 kg Germanium byla 2014 o 1.900 USD. Podle EU byla cena 2003u 300 USD / kg, která se zvýšila na 2009 USD o 1.000.
Pro znázornění germania, zejména kouřových plynů (obsahují oxid gemanu ( 

Eigenschaften
elementární germanium
Germanium je v periodické tabulce v řadě polokovů, ale podle nedávné definice je klasifikován jako polovodič. Elementární germanium je velmi křehké a velmi stabilní na vzduchu při pokojové teplotě. Oxiduje se na oxid germannatý (GeO2) pouze po silném žíhání v kyslíkové atmosféře. GeO2 je dimorfní a je konvertován při 1033 ° C pomocí rutilní modifikace (CN = 6) na strukturu ß-křemene (CN = 4). V práškové formě je to hořlavá pevná látka a může být snadno zapálena krátkým vystavením zdroji zapálení a po odstranění pokračuje v hoření. Riziko vznícení je větší, čím jemnější je látka distribuována. V kompaktní formě není hořlavý. Germanium je bivalentní a čtyřmocné. Sloučeniny germania (IV) jsou nejstabilnější. Kyselina chlorovodíková, roztok hydroxidu draselného a zředěná kyselina sírová germanium nejsou napadeny. V alkalických roztocích peroxidu vodíku, koncentrované horké kyselině sírové a koncentrované kyselině dusičné se však rozpustí za vzniku hydrátu oxidu germaničitého. Podle polohy v periodické tabulce jsou jeho chemické vlastnosti mezi křemíkem a cínem.
Germanium je jednou z mála látek, které mají vlastnost anomálie hustoty. Jeho hustota je v pevném stavu nižší než v kapalném stavu. Jeho mezera v pásmu je přibližně 0,67 eV při pokojové teplotě.
Germaniové oplatky jsou výrazně křehčí než křemíkové oplatky.
Verwendung
Elektronika
Jako polovodič bylo germanium v monokrystalické formě hlavním materiálem v elektronickém centru 20u. Zejména pro výrobu prvních germaniových diod a bipolárních tranzistorů dostupných na trhu, dokud nebyl v těchto oblastech nahrazen křemíkem. Dnes se aplikace nacházejí ve vysokofrekvenční technologii (například jako polovodič křemíku germanium) a v detekční technologii (například jako rentgenový detektor). Solární články Gallium arsenide (GaAs) jsou někdy vyrobeny z germárových oplatek. Mřížková konstanta germania je velmi podobná mřížce arzenidu gallia, takže GaAs epitaxně roste na monokrystalech germania.
Brýle a vlákna
Druhé hlavní použití je v oblasti infračervené optiky ve formě oken a čočkových systémů vyrobených z polykrystalického nebo monokrystalického germania a optických skel s infračervenou propustností, tzv. Chalkogenidových skel. Aplikace zahrnují vojenské a civilní zařízení pro noční vidění a termovizní kamery.
Jiná hlavní použití jsou ve výrobě optických vláken a polyesterových vláken: V moderních skleněných vláknech pro telekomunikace se tetrachlorid germanitý používá v chemické depozici par k výrobě oxidu germania ve vnitřním jádru vlákna. To má za následek vyšší index lomu v jádru ve srovnání s vláknitým povlakem, čímž je zajištěno vedení světelných vln. V polyesterové chemii se oxid germaničitý používá jako katalyzátor při výrobě určitých polyesterových vláken a granulátů, zejména pro recyklovatelné PET lahve (PET = polyethylen tereftalát).
Jaderná medicína a jaderná technologie
68Ge se používá v generátoru Gallium 68 jako rodičovský nuklid pro výrobu Gallium-68. Podobně se 68Ge používá jako zdroj pro kalibraci detektoru v pozitronové emisní tomografii.
Jako vysoce čisté monokrystalické germanium se používá jako detektor záření.
Germanium v doplňcích výživy
Látka Bi (karboxyethyl) germanium seskvioxid (Ge-132) byla nabízena jako potravinový doplněk pro použití u řady onemocnění, včetně rakoviny, syndromu chronické únavy, imunodeficience, AIDS, hypertenze, artritidy a potravinových alergií. Pozitivní účinky na průběh nemoci dosud nebyly vědecky prokázány.
Podle evropské směrnice 2002 / 46 / ES o sbližování právních předpisů členských států týkajících se doplňků stravy by nemělo být germanium používáno v doplňcích stravy. V mnoha zemích EU, které již harmonizovaly své vnitrostátní právní předpisy, včetně Německa a Rakouska, není proto přidání germania jako zdroje minerálů do doplňků stravy povoleno.
Příslušné orgány výslovně varují před konzumací Ge-132, protože nelze vyloučit závažné účinky na zdraví a úmrtí.
Léčivé použití germania
Terapeutická účinnost antineoplastické látky spirogermanium u rakoviny nebyla prokázána. Schválené hotové léčivé přípravky s účinnou látkou spirogermanium neexistují. V Německu jsou farmaceutické přípravky (formulace) obsahující germánium, kromě homeopatických ředění od D4, považovány za sporné. Jejich výroba a dodání jsou proto zakázány. Germanium metalum je k dispozici ve formě homeopatických léků. Jako součást homeopatických přípravků je popsán laktát draselný germaniumcitrát.
fyziologie
Germanium a jeho sloučeniny mají relativně nízkou toxicitu. Stopy germania jsou zahrnuty v následujících potravinách: fazole, rajčatová šťáva, ústřice, tuňák a česnek. Není to nezbytný stopový prvek podle stavu techniky. Neexistuje žádná známá biologická funkce pro germanium. Byl diskutován možný vliv na metabolismus uhlohydrátů. Nejsou známy žádné nemoci z nedostatku germania.
toxicity
V minulosti k otravě germaniem u lidí došlo až po příjmu anorganických sloučenin germania jako doplňku stravy. První příznaky jsou ztráta chuti k jídlu, hubnutí, únava a svalová slabost. Následuje selhání ledvin až do selhání ledvin, které může být pro pacienta smrtelné. Je také popsána periferní neuropatie v důsledku onemocnění.
Při užívání spirogermania v klinických studiích jsou hlášeny přechodné neurotoxické vedlejší účinky. Spiro-germanium bylo testováno jako cytostatikum v 1980 letech. Údaje ze studií na zdravých dobrovolnících nejsou k dispozici.
Z pokusů na zvířatech je známo, že germanium má nízkou akutní orální toxicitu. Mezi příznaky akutní otravy velkými dávkami sloučenin germania patří:
- Dilatace krevních cév (artectasia)
- Ptosis
- cyanóza
- Tremor
Konečně, respirační paralýza vede ke smrti experimentálních zvířat. Příznaky chronické nebo subchronické otravy anorganickými germaniovými sloučeninami jsou:
- hubnutí
- Orgánové změny (množství orgánů)
- Progresivní neuropatie
- poškození ledvin
Organické sloučeniny germania vykazovaly nižší toxicitu, ale u experimentálních zvířat vedly ke snížení hmotnosti a ke snížení počtu červených krvinek. O teratogenních účincích germania jsou jen omezené údaje. Germanát sodný byl testován na potkanech jako nekarcinogenní.
Mechanismus toxicity germania není dosud zcela objasněn. Byly však pozorovány specifické patologické účinky na mitochondrie ledvin a nervových buněk.
interakce
Je také diskutováno, zda germanium může vykazovat interakce s křemíkem v kostním metabolismu. Může blokovat účinek diuretik a snížit aktivitu řady enzymů, jako jsou dehydrogenázy. V pokusech na zvířatech vykazují myši prodloužené trvání spánku indukované hexabarbitálem, když byly dodatečně léčeny sloučeninami germania. To naznačuje, že aktivita cytochromu P450 je také omezená. Existují zprávy o organických germaniových sloučeninách blokujících detoxikační enzym glutathion-S-transferázu.
Biologická dostupnost a metabolismus
Germanium se při požití snadno vstřebává do těla. Je distribuován v celé tkáni těla, zejména v ledvinách a štítné žláze. Na rozdíl od anorganických sloučenin germania se organogermany v lidském těle nehromadí. Existuje však jen několik studií metabolismu germania.
V zásadě se vylučuje močí. Vylučování se také provádí žlučem a stolicí.
Připojení
Germanium tvoří Ge (II) - u. stabilnější Ge (IV) sloučeniny, jen málo z nich má technický význam.
Z halogenidů germania jsou také Ge (II) - u. Ge (IV) zástupce je znám. Chlorid Germanium (GeCl4), kapalina s bodem varu 83 ° C, se při vystavení působení chlorovodíku oxidům germania tvoří a je důležitým meziproduktem při získávání germania. Vysoce čistá GeCl4 se používá při výrobě optických vláken z křemenného skla k výrobě vrstvy oxidu germania (IV) s vysokou čistotou na vnitřní straně křemenných vláken. Pro výrobu vysoce čistých germaniových vrstev je také možné použít disproporcionaci jodidu germania (II) za vzniku jodidu germania a germania (IV):
Germanáty jsou sloučeniny germania odvozeného od jeho oxidu. Téměř ve všech minerálech obsahujících germanium je germanium přítomno jako germanát.
Němci se nazývají vodíkové sloučeniny germania, které tvoří homologní řadu různých molekul dlouhého řetězce. Monogerman nebo germaniumhydrid (GeH4) je plyn používaný v polovodičovém průmyslu k epitaxii a dopingu.
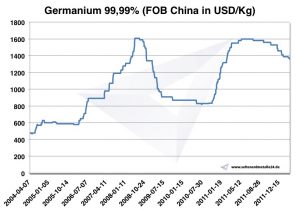
Graf Germanium 2004-2011

