Vizmut, Bi, atomové číslo 83
Vizmut - historie, výskyt, těžba, použití a ceny vizmutu
Vizmut nebo bizmut (zastaralý také: vizmut) je chemický prvek se symbolem prvku Bi a atomovým číslem 83. V periodické tabulce je v 5. Hlavní skupina nebo skupina dusíku.
Není znám žádný stabilní izotop. Avšak extrémně nízký poločas extrémně nízké radioaktivity přirozeně se vyskytujícího 209Bi je pro praktické použití irelevantní. Radioaktivitu bylo možné detekovat pouze 2003, protože dříve nebyly k dispozici potřebné vysoce citlivé metody měření; 1990Bi byl v 209 letech považován za nejtěžší stabilní nuklid.
Historie
Jako samostatný prvek se bizmut stal středem 18u. Století demonstrovali chemici Claude Francois Geoffroy, Johann Heinrich Pott, Carl Wilhelm Scheele a Torbern Olof Bergman. Dříve to bylo často považováno za derivát olova, cínu, antimonu a dalších kovů nebo minerálů. V knize Užitečná horská kniha (asi 1527) je ruda bizmutu (wissmad arzcz) zmíněna jako společník stříbrné rudy. Později v 16. Century Georgius Agricola se pokusil o přesnější rozlišení.
Název kovu, který se objevuje jako wesemut v německém 1390 a lat. 1450 jako wismutum, 1530 jako bisemutum, lze převést do arabského Dioscuriho překladu 9. Century dokumentovaná forma b [i] sīmūtīyūn lze připsat, což je samo o sobě pravděpodobně transliterace starořeckého ψιμύθιον psimýthion, lead white 'představuje. Byla také přijata geneze arabského i'mid, antimonu; Georgen na údajně první vzpourě v dole St. Georgen na loukách poblíž Schneebergu v Erzgebirge v 15u. Století, nebo na variantě wis (se) mat. což znamená „bílá hmota“.
Chemický symbol Bi navrhl JJ Berzelius v roce 1814.
výskyt
Vizmut se vyskytuje přirozeně v přírodě, to je v elementární formě a Mezinárodní minerální asociace (IMA) je považována za minerál. 9 používaný IMA. Vydání klasifikace minerálů po Karl Hugo Strunz vede bismut spolu s antimonem, arsenem a stibarsenem v členění arsenových prvků pod systém č. 1.CA.05 (zastaralá edice 8: I / B.01-40). V převážně používané v anglicky mluvící klasifikaci nerostů podle Dana Bismuth patří do „arzénové skupiny“ se systémem č. 01.03.01.
Pevný bizmut se tvoří v hydrotermálních žilách pegmatitů a topaz-obsahujících cín-wolframových křemenných žil a obvykle společně s různými měděnými, niklovými, stříbrnými a cínovými rudami. Bizmut málokdy vyvíjí dobře tvarované krystalové formy, ale může dosáhnout velikosti až 12 centimetrů. Obvykle se vyskytuje ve formě dendritických, listnatých nebo zrnitých agregátů, ale také jako polysyntetická dvojčata s rovnoběžnými pruhy („peří bizmut“) nebo nálevkovité boční povrchy vtažené do středu krystalu.
(Jak 2011) Zatím asi 1400 lokality pro důstojné vizmutu jsou považovány za známou. Tyto stránky jsou hlavně v Austrálii, Bolívii, Číně, Kanadě, Mexiku, Peru a ve Španělsku, historicky Bieber v Spessart a v Krušných horách, kde bismut (a to jak v čisté formě, tak jako sulfidu (Bismuthinit) selenid (Selenidbismutglanz) a oxidu se nachází bismite). Kromě toho je vizmut, stejně jako antimon a arzen, někdy jako dvojité sulfidu před: Galenobismutit (PbBi2S4) Lillianit (Pb3Bi2S6) Silberbismutglanz (AgBiS2) Kupferbismutglanz (CuBiS2) a Kupferbismutblende (Cu6Bi2S6). Je známo také tellur sulfid ve formě Tellurbismut (Bi2Te2S) a křemičitan názvem Eulytin (Bi4 (SiO4) 3).
Celkově je známo, včetně solidního bizmutu kolem minerálů bizmutu 230.
Extrakce a prezentace
Pro výrobu bizmutu lze předpokládat oxidické nebo sulfidické rudy.
Oxidové rudy jsou redukovány na bizmut v uhelných pecích:
Sulfidové bizmutové soli mohou být redukovány pomocí železa metodou srážení:
Nebo se sulfidické rudy nejprve převedou na oxidy a poté se redukují uhlí (Röderova redukční metoda):
Surový bizmut se pak odstraní oxidací tání dalších prvků (antimonu, arsenu, olova, železa a síry). Měď se odstraní roztavením sulfidem sodným, zlatem a stříbrem extrakcí roztaveného bizmutu cínem.
Eigenschaften
Fyzikální vlastnosti
Vizmut je stříbro-bílý, křehký a hrubě krystalický kov nebo polokov s nádechem růžové. Má rhombohedrální krystalovou strukturu s velmi hustě zabalenými dvojvrstvy. Nejkratší vzdálenost mezi dvěma dvojitými vrstvami je 352,9 pm, což je pouze o 15% větší než nejmenší vzdálenost mezi dvěma atomy v dvojité vrstvě. Monokrystaly vizmutu vykazují výrazné štěpení paralelní s těmito dvojvrstvy.
Vizmut má nejsilnější Hallův účinek ze všech kovových prvků a jako polokov v čisté formě má nízkou elektrickou vodivost. Ukazuje - kromě supravodičů a pyrolytického grafitu - mimo nejsilnější diamagnetickou vlastnost, je vytlačena z externě aplikovaného magnetického pole. Schubnikow-de-Haasův efekt (oscilace elektrického odporu v externím magnetickém poli) byl poprvé pozorován na krystalech bizmutu a změřen. Před vývojem Hallových senzorů a polních desek byla k měření magnetických polí použita tzv. Vizmutová spirála, cívka s navinutým tenkým izolovaným bismutovým drátem. Změna odporu cívky vlivem měnícího se magnetického pole byla ve srovnání s dnešními senzory rozhodně velmi malá.
Existují dvě známé modifikace vizmutu: vizmut, který je běžný při pokojové teplotě, tvoří kubickou strukturu kubického těla soustředěnou pod vysokým tlakem (jak 9 GPa).
Kapalný bizmut expanduje jako jedna z mála látek, když ztuhne (anomálie hustoty). Tento jev je také pozorován v galliu, germaniu, plutonia, křemíku, teluru a vodě. Je založeno na bizmutu, že během tavení (a tuhnutí) dochází k dvojfázovému přechodu: jakmile je fázový přechod 1. Pořadí od pevné látky k kapalině (obvykle s malým poklesem hustoty) a navíc fázový přechod 1. Řád metaloidu na kov se značným nárůstem hustoty, což také vysvětluje neobvykle velkou entropii fúze 21,1 J / (K · mol) a náhlé zvýšení elektrické vodivosti taveniny bizmutu.
Chemické vlastnosti
Vizmut je odolný vůči suchému vzduchu při normální teplotě. Ve vlhkém vzduchu se však na povrchu tvoří oxidová vrstva. Kromě toho je vizmut odolný vůči vodě a neoxidujícím kyselinám (kyselina chlorovodíková a zředěná kyselina sírová). V oxidujících kyselinách (kyselina dusičná nebo horká koncentrovaná kyselina sírová) se bizmut rozpustí za vzniku bizmutových solí (BiX3). V práškové formě je to hořlavá pevná látka, kterou lze snadno zapálit krátkým vystavením zdroje zapálení a po odstranění pokračuje v hoření. Riziko vznícení je větší, čím jemnější je látka distribuována. Kov v kompaktní formě není hořlavý.
Když se rozžhaví, hoří bizmut namodralým plamenem na hnědožlutý oxid kouř - bismut (III) (Bi2O3).
V horkém stavu se bizmut kombinuje přímo s halogeny a přímo se sírou, selenem a telurem. Vizmut nereaguje s dusíkem a fosforem.
izotop
Přirozený bizmut sestává pouze z izotopu 209Bi. V 2003, Institut d'astrophysique spatiale, Orsay, Francie, zjistil, že tento izotop, který byl dosud stabilní, je alfa emitor s poločasem rozpadu (1,9 ± 0,2) 1019 (přibližně 19 bilionů let). Velmi pomalý rozpad 209Bi v 205Tl je na jedné straně založen na bezprostřední blízkosti dvojitého magického 208Pb v izotopovém schématu a na skutečnosti, že samotný 209Bi je prostě magický. Dlouhý poločas vede k aktivitě 0,0033 Bq / kg (odpovídá jedinému jadernému rozkladu za pět minut a kilogramů).
209Bi je předposledním členem řady Neptunium a kromě 205Tl je jediný, který je stále přirozený. Protože nuklidy, které jsou na začátku série Neptunium, jsou nyní inkubovány v jaderných reaktorech, množství 209Bi na Zemi v průběhu času roste.
Verwendung
Vizmut se používá jako slitinová složka v nízkotavitelných slitinách, například pro Woodův kov, který se taví při 70 ° C, pro Roseův kov s teplotou tavení 98 ° C a pro Lipowitzův kov, který se taví při 60 ° C.
Technické použití
Slitina Bismanol s manganem je silný permanentní magnet.
V povlakových slitinách (pocínování ponořením) pro solární konektory slouží jako náhrada za olovo.
Syntetické monokrystaly bizmutu o rozměrech více než 20 centimetrů a polykrystalické destičky bizmutu se používají jako neutronové filtry pro zkoumání materiálů ve výzkumných reaktorech.
Tellurid chemické sloučeniny bizmutu čerpá tepelnou energii do Peltierových prvků.
Materiál fázové změny některých DVD-RAM obsahuje vizmut, viz Technologie fázové změny.
Vizmut je propagován některými zdroji jako legující prvek ve volně řezných ocelích jako náhrada olova. Měla by zlepšit obrobitelnost těchto ocelí bez negativních ekologických vlastností olova. Z hlediska metalurgie oceli je to však nepříznivé, protože vizmut se prakticky nemůže metalurgicky odstranit a poté se v ocelích vyrobených ze šrotu objeví jako nežádoucí doprovodný prvek. V elektronickém průmyslu se slitina bizmutu cínu používá jako náhrada (klíčové slovo RoHS) olovnatých pájek. Nevýhodou je, že pro bismutinový cín je vyžadováno vlastní pájecí zařízení. Kontaminace olovem (např. Oprava starého zařízení) má za následek velmi nízkou teplotu tání, zatímco použití nástrojů ze slitiny cínu a stříbra vede k vysokým teplotám a kontaminaci nástroje vizmutu.
Oxid bizmutu se používá pro výrobu optických skel a pro slinovací pomůcky v technické keramice. Rovněž najde uplatnění ve formě germátu bizmutu jako scintilačního detektoru v pozitronové emisní tomografii (PET).
V Sovětském svazu byla použita slitina olovo-bizmut jako chladivo pro jaderné reaktory. I když je tato slitina účinnější než běžné chlazení vodou pod tlakem, je s ní obtížnější manipulace. Slitina ztuhne při teplotě pod 125 ° C a může způsobit velké poškození reaktoru. Tyto reaktory byly používány mimo jiné na jaderných ponorkách (např. Ponorka Alfa třídy).
Vizmut se také používá jako netoxická olověná náhražka brokové munice. To však není příliš běžné.
V 16. Století bylo vyvinuto v jižním Německu a ve Švýcarsku malířskou technikou, při které byl bizmut použit jako nátěr pro menší dekorativní krabice nebo krabice, částečně také pro dřevěné oltáře. Tato technika se nazývá vizmutová malba.
Použití v chemickém průmyslu
Oxid bismutitý (BiOCl) se v kosmetice používá jako stříbro-bílý perleťový pigment.
Bismuth vanadate se používá jako zelenkavý žlutý pigment s vysokou odolností vůči povětrnostním vlivům a nachází z. B. u vysoce kvalitních barev, emulzních barev pro fasádní použití, plastů a tiskových barev.
Kromě toho se bizmut používá jako katalyzátor v chemickém průmyslu.
Lékařské použití
Sloučeniny bizmutu, jako je dibismuth tris (tetraoxodialuminát), nitrát bizmutu (subtitrát bizmutu, základní dusičnan bizmutu), se používají jako součást antibiotické terapie proti použití patogenu Helicobacter pylori, který může způsobit vředy v žaludku a dvanáctníku (eradikační terapie). Jedná se o tzv. Čtyřnásobnou terapii (kombinovaná terapie inhibitorem protonové pumpy a trojitá terapie bizmutem [sůl bizmutu, tetracyklin, metronidazol).
Sloučeniny bizmutu se také částečně používají při průjmech jako adstringenty a snižující zápach při špatném dechu a nadýmání. Kromě toho se některé sloučeniny (např. Bibrokatol) používají jako antiseptické.
Kromě toho je bismut diagnosticky používán v pozitronové emisní tomografii ve formě germátu bizmutu jako detekčního materiálu tomografického aparátu.
Historicky byl bizmut na konci 19u. Století jako součást použitých ran na rány (např. Dermatol). Od let 1920 se používá jako lék na syfilis. Byl však zcela nahrazen moderními antibiotiky.
Soli vizmutu se také používají jako rentgenové kontrastní látky pro vizualizaci gastrointestinálního traktu (tzv. Bizmutová moučka). Zde byla bizmutová sůl nahrazena síranem barnatým.
Bismuth galát se používá v přípravku Stolte pro kožní masti a mast lze použít k léčbě zánětlivé kůže u kojenců.
otrava
Otrava bizmutem (bismuthismus) je vzácná kvůli špatné absorpci v gastrointestinálním traktu. Je velmi podobný otravě rtutí. Typický je výskyt břidlicově šedého bizmutu bizmutu (depozice sulfidu bizmutu) na ústní sliznici s tvorbou ústní sliznice (stomatitida) a gingivitidy (s uvolněním zubů, ztrátou), střevní enteritidou s průjmem a poškozením ledvin (nefropatie bizmutu).
důkaz
Vizmut je detekován bismutovým skluzem s thiomočovinou. K vysrážení nežádoucích interferujících iontů se používá fluorid sodný, chlorid sodný a vinan draselný.
NaF pro komplexaci Fe3 + a Al3 +
NaCl pro srážení Ag + a Hg22 +
Tartrate pro komplexaci Sb3 + a Sn2 +
V přítomnosti Bi3 + se vytvoří krystalický komplex citronově žluté thiomočoviny, ve kterém jsou tři thiomočovinové molekuly spojeny s bizmutem přes síru:
![{\displaystyle {\ce {\rm {Bi^{3+}{+}3SCN2H4{->}[Bi(SCN2H4)3]^{3+}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c283de06adc520701a39cebdb2d9f9e206572f68)
Alternativní detekční reakce:
Při redoxní reakci s ionty cínu (II) jako redukčním činidlem precipituje elementární bizmut černý.
S roztokem jodidu sodného: nejprve se vysráží černý jodid bismutitý (III), který se pak rozpustí v přebytku jodidu jako oranžový komplex tetraiodobismutátu:
![{\ displaystyle {\ ce {\ rm {Bi ^ {3 +} {+} 4I ^ {-} {->} [BiI4] ^ {-}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8f1a3e20448941130afb1ebcb56f6ed3bd093dad)
1,3,4-thiadiazol-2,5-dithiol je také vhodný jako komplexotvorné činidlo pro detekci.
Připojení
Vizmut je primárně trojmocný, ale existuje také jeden a pětimocný bizmut; Oxid bismutitý (V) je však velmi silné oxidační činidlo, které dokonce oxiduje mangan (II) na permanganát. Vytváří také polymerní kationty. Je stabilní ve vzduchu.
- kyslíkaté sloučeniny
Oxid bizmutu (III) (vizmut, také nazývaný stolice bizmutu) - sloučeniny síry
Bismutu (III) sulfid - sloučeniny vodíku
Bismuth vodík (bismuthan) - Halogenidy a dusičnany
Fluoridy: fluorid bizmutitý, fluorid bizmutitý, fluorid oxid bismutitý
Chloridy: chlorid bismutitý, chlorid bismutitý, oxid bismutitý
Bromidy: subbromid bismutu, bromid bismutitý, bromid oxid bismutitý
Jodidy: jodid bismutitý, jodid bismutitý, jodid oxidu bismutitého
Dusičnany: nitrát oxidu bismutitého (subtitrát bizmutu) - Jako anion
bismutičnanu sodného (V)
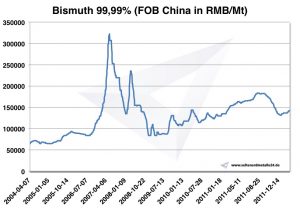
Graf Bismuth 2004 2011



