Antimon, Sb, atomové číslo 51
Cena antimonu, historie, výskyt, těžba a použití
antimon
Antimon (z latiny Antimonium, pravděpodobně z arabštiny „al -ithithîn (un)“) je chemický prvek se symbolem prvku Sb (z latiny Stibium, (šedý) štika) a atomovým číslem 51 V periodické tabulce je v 5. Období a hlavní skupina 5, nebo 15, IUPAC nebo dusík, ve stabilní úpravě je to lesklý a křehký polokov.
Jméno, historie
To je také věřil, že jméno sahá až do pozdního řeckého anthemon (německý květ). Cílem bylo popsat stonkovité krystaly sulfidu antimonitého, které vypadaly jako chomáčky květů a vypadaly jako květina. V 11. Století se nachází latinský termín pro antimonium pro minerální medicínu pro interní terapii nemocí, poté u Constantinus Africanus.
V 17. V 19. století, jméno antimon byl používán se odkazovat na kov. Koptský termín pro prášek na bázi sulfidu antimonu prošel řeckou cestou v latinském stibiu. Zkratka Sb, kterou používá švédský lékař a chemik Jöns Jakob Berzelius („otec moderní chemie“), se dodnes používá jako symbol prvku.
Pozdní legendární lidová etymologie zvěčněná Samuelem Johnsonem ve svém slovníku říká, že německý mnich Basilius Valentinus poznamenal, že prasata absorbováním antimonu rychle ztuhla. Zkoušel to také na svých bratrech, načež zemřeli, takže byl vytvořen pojem „antimoine“ (antimon), z něhož byl později vytvořen „antimon“.
Typickou lokalitou pro pevné antimon je stříbrný důl ve švédské obci Sala ve Västmanlandu. Číňané a Babylončané však již byli známí jako kovové antimony. Některé z jeho sloučenin se již používaly v době bronzové jako doplněk mědi k výrobě bronzu (nálezy Velem St. Vid v Maďarsku).
výskyt
Antimon je vzácný prvek. Protože se vyskytuje také v přírodě (tj. V elementární formě), je certifikována Mezinárodní mineralogickou asociací (IMA) pod systémem č. 1.CA.05 rozpoznán jako minerál.
Pevné antimony (2011) byly detekovány po celém světě v lokalitách 300. Takže mimo jiné v několika regionech Austrálie; v bolivijských departementech La Paz a Potosí; Minas Gerais v Brazílii; Černý les, Fichtelgebirge, Horní Falc, Odenwald a Harz v Německu; Seinäjoki ve Finsku; několik regionů Francie; Lombardie, Piemont, Sardinie a Trentino Alto Adige v Itálii; některé regiony Kanady; některé regiony Rakouska; Východní a západní Sibiř a Ural v Rusku; kromě švédských Västmanland, Dalarna, Gästrikland, Närke, Södermanland, Värmland a Västerbotten; v některých regionech Slovenska; Čechy a Morava v České republice i v mnoha regionech USA. Jedním z nejdůležitějších ložisek pevných antimonových a antimonových rud na světě je Murchisonův kamenný pás v Murchison Range v Jižní Africe.
Doposud jsou známy antimonové minerály 264 (jako: 2010). Používá se především sulfidový minerál Stibnit Sb2S3 (Grauspießglanz) s maximálním obsahem 71,7% Sb. Minerál s nejvyšším obsahem Sb v chemické sloučenině je přírodní antimonová slitina arsenu Paradocrasit (max. 92%). Na rozdíl od Stibnitu (kolem lokalit 2500) však přichází s pouze třemi lokalitami, které jsou mnohem méně běžné. Dalšími zdroji antimonu jsou minerály Valentinit Sb2O3 (Weißspießglanz), Breithauptit NiSb (antimonový nikl, antimonid niklu), Kermesit Sb2S2O (zlatá síra).
Extrakce a prezentace
Technicky je antimon extrahován z antimonového lesku. Jedna metoda je založena na pražení a redukci uhlíkem (metoda redukční redukce):
Další možností je provedení redukce železem (metoda srážení):
Celosvětově byly na začátku 21. Století mezi 110.000 a 160.000 tun za rok podporovaného antimonu. Od 1900 se výkon zvýšil více než desetkrát.
87% produkce antimonu se odehrává v Číně (od: 2015).
Eigenschaften
Antimon může nastat ve třech různých modifikacích, s kovovým nebo šedým antimonem být nejvíce konzistentní modifikací.
Za normálních podmínek krystalizuje antimon trigonal v kosočtvercovém uspořádání ve vesmírné skupině R3m (č. 166) popsané podle symboliky Hermann Mauguin s parametry mřížky a = 431 pm a c = 1127 pm, jakož i šesti jednotkami vzorce na jednotku buňky.
Po ochlazení par antimonu na chladných površích se vytvoří amorfní, černý a vysoce reaktivní antimon, který se ohřevem přemění zpět na kovové antimon. Elektrolytická výroba vytváří výbušné antimony, které, když jsou popraskané, se výbušně rozžhaví a jiskří na kovové antimon. Tato forma však vždy obsahuje nějaký chlor a nelze ji považovat za změnu. Žluté antimon není také nezávislá modifikace, ale vysoce polymerní chemická sloučenina s vodíkem.
Fyzikální vlastnosti
Kovové antimony jsou stříbrně bílé, velmi lesklé, šupinovitě krystalické. Díky své křehkosti je snadno rozdrtit. Elektrická a tepelná vodivost je nízká.
Chemické vlastnosti
S rodícím se vodíkem reaguje antimon s nestabilním hydridem antimonu SbH3. Vzduch a voda nenapadají antimon při pokojové teplotě. Nad bodem tání hoří na vzduchu modro-bílým plamenem na oxid antimonitý (III). Rozpouští se v horkých koncentrovaných minerálních kyselinách. S halogeny reaguje rázně při pokojové teplotě na odpovídající halogenidy.
Ve sloučeninách je antimon přítomen hlavně v oxidačních stavech + 3 a + 5. V kovových antimonidech, jako je antimonid draselný K3Sb, tvoří ionty Sb3.
izotop
Existují dva stabilní izotopy antimonu: 121Sb a 123Sb.
Použití a slitiny
Většina vyrobeného antimonu je zpracována na slitiny a vykazuje následující vlastnosti:
Slouží k vytvrzení slitin olova a cínu. Na rozdíl od většiny ostatních kovů se expanduje po ochlazení taveniny (v důsledku přeměny na jinou modifikaci): obsah antimonu může být upraven tak, aby se tyto slitiny při smršťování smršťovaly ani se trochu neroztahovaly; Když jsou součásti vyráběny v odlévacích formách, kov lisuje během tuhnutí ve všech rozích a úhlech, takže i složité tvary a silně vzorkované povrchy mohou být zbaveny dutin.
Důležité slitiny:
- Slitiny olovnatého antimonu: tvrdý olovo, dopisní kov, ložiskový kov, olověný akumulátor, olověný plášť pro podzemní kabely
- Slitiny cínu a antimonu: kov Britannia, ložiskový kov
- Výroba polovodičů, např. B. dopováním křemíku pro výrobu polovodičů sloučeniny III V
- Slitiny cínu a antimonu a mědi (Babbit kov) pro ložiska kovů
- Slitiny cínu a antimonu a mědi pro cín a jiné výrobky z cínu
tzv. pájka nebo měkká pájka - Hliníkové antimony, antimon galia, antimon india pro infračervené a Hallův efekt
- Nesmršťující slitiny antimonu pro přesné lití
Medicína
Antimon (nebo přípravek získaný z antimonové rudy) byl v 16u. a 17. Stal se (iatrochemickým) „hlavním lékem“, ale byl - stejně jako ostatní paracelsovské drogy - kontroverzní a ve Francii zakázán i mezi 1615 a 1688.
Tatarský kámen se dlouho používá jako refrakční činidlo (antimonová pilulka), dnes se někdy používá ke studiu obsahu žaludku u ptáků.
Schistosomiáza i trypanosomy začaly na začátku 19u. Století s Brechweinsteinem (Kaliumantimonyltartrat) bojovalo. Tatarský kámen byl vyroben skladováním vína v antimonovém šálku na jeden den a následným pitím. Mezitím se používají účinnější a kompatibilnější léky.
Doplňky antimonu se běžně používají jako méně toxické pentavalentní formy pro lékovou terapii leishmaniózy a schistosomiázy, ale v rozvinutých zemích již nejsou drogou první volby. Antimon inhibuje enzym fosfhofructokinázu, což je rychlostní limitující krok v glykolýze.
více
- Klingling match
- Část rozbušek výbušniny a olověná munice.
- Trisulfid antimonitý v brzdových obloženích vozidel
Antimon (V) sulfidu: - pro výrobu (vulkanizace) červené gumy (příklad: laboratorní gumové hadice)
- jako červená součást střelecké hlavy v zápasech
- dříve než oční make-up a v oftalmologii ("Augenerweiterer")
- Chromát antimonu jako žlutý barevný pigment
oxidy antimonu - Katalyzátor pro výrobu polyesteru a PET (oxid antimonitý)
- jako bílý pigment pro barvení polystyrenu, polyethylenu a polypropylenu
- Výroba bílých glazur a frit (porcelán)
- Čištění olovnatého skla
- dotovaný cínem jako transparentní vodivý povlak ("ATO" antimonové oxidy cínu), například na brýle, pro výrobu displejů nebo v elektricky vodivých pigmentech ("Minatec"), pro podlahové krytiny pro rozptylování elektrostatických nábojů.
- v pigmentech ("Lazerflair") pro laserové značení plastových dílů, protože značná absorpce infračerveného záření obvykle značkovací laser (Nd: YAG).
- v maskování kvůli silné infračervené absorpci.
- jako retardér hoření a jako součást barev odolných proti ohni a retardérů hoření,
- Plasty a textilie pro kabelové opláštění, potahy autosedaček, záclonové tkaniny, dětské oblečení a další. Ä.
- Soli antimonu jako součást pesticidů, skvrn a ohňostrojů
- Oddělovač pro zlato: pro srážení stříbra z taveniny zlata
toxicity
Antimon může být fatální při požití z 200 na 1200 mg. V toxikologii jsou známy tři formy antimonu, z nichž plynný antimon hydrid (Stiban, SbH3) je nejnebezpečnější formou vyvolávající masivní hemolýzu. Po toxicitě následuje tatarská emetika s trojmocným („trojmocným“) antimonem, zatímco pentavalentní antimon je nejméně toxický.
Trivalentní antimon je absorbován do červených krvinek během prvních dvou hodin po požití na 95%, a tak obohacen hlavně v silně perfundovaných orgánech. Vylučování je způsobeno převážně vazbou na glutathion žlučí s odpovídajícím vysokým enterohepatickým oběhem a pouze malá část je vylučována ledvinami. Antimonyltartrát draselný se vylučuje na 90% během prvního dne po požití, zbytek je 10% v důsledku pomalejší kinetiky vylučování během 16 dnů.
Má se za to, že antimon, stejně jako arsen, inhibuje funkci komplexu pyruvát dehydrogenázy, což vede k nedostatku intracelulárního nosiče energie adenosintrifosfátu (ATP). To vede k tvorbě chelátových komplexů mezi antimonovými a thiolovými skupinami odpovídajících enzymů. V těle je toxický v mnoha orgánech, včetně zažívacího traktu, jater, ledvin, srdce a centrálního nervového systému. Nejvyšší koncentrace dosahuje antimonu v játrech, kde může dojít k hepatitidě až do selhání jater. Srdcem jsou změny EKG s inverzí a redukcí T-vlny a prodlouženým QT intervalem. Akutní selhání ledvin může vést k dočasné nebo trvalé hemodialýze.
Kromě podpůrných opatření, jako je infuzní terapie (jak pro kompenzaci ztráty tekutin zvracením, tak pro ochranu ledvin) a pečlivé sledování životních funkcí a EKG, se pro antimikrobiální otravu používá aktivní uhlí, N-acetylcystein jako prekurzor glutathionu. zvýšená sekrece a chelatační činidlo, např. B. Dimercaprol.
Výsledky výzkumu ukazují, že sloučeniny antimonu dráždí pokožku a sliznice. Tyto sloučeniny se pravděpodobně rozpustí z plastů a textilií.
Bezpečnostní pokyny a mezní hodnoty
EU z antimonových sloučenin klasifikovala fluorid antimonitý jako toxický (T) a chloridy jako žíravý (C) a jako nebezpečný pro životní prostředí (N); všechny ostatní sloučeniny antimonu jako škodlivé (Xn) a nebezpečné pro životní prostředí (N). Samotný antimon tam není uveden, podle bezpečnostního listu je označen jako dráždivý.
Mezinárodní agentura pro výzkum rakoviny (IARC) klasifikuje oxid antimonitý (III) jako možnou karcinogenní látku.
V EU má pitná voda limit 5 μg / l. Vyšetření ovocné šťávy balené do PET lahví (pro které neexistují žádné pokyny) odhalilo koncentrace antimonu až do 44,7 μg / l v neředěných koncentrátech šťávy.
EU přidala do 2016 antimon podle nařízení (ES) č. 1907 / 2006 (REACH) v souvislosti s hodnocením látky v průběžném akčním plánu Společenství (CoRAP). Přehodnotí dopad látky na lidské zdraví nebo na životní prostředí a případně zahájí následná opatření. Hlavními důvody pro přijetí antimonu byly obavy z expozice pracovníků, vysoké (agregované) prostornosti, vysokého poměru rizik (RCR) a rozšířeného používání, jakož i potenciální riziko karcinogenních vlastností. Přecenění probíhá od 2018 a provádí ho Německo.
důkaz
Předběžné testy:
Plamenové zbarvení: plamen světle modrá, málo charakteristická Phosphorsalzperle: Bezbarvá (narušena všemi prvky, které vytvářejí barevnou perlu)
Detekční reakce:
Snížení pomocí obecných kovů, například železa, zinku nebo cínu.
V nekyselých roztocích redukují základní kovy antimonové kationty Sb (III), Sb (V) a Sb (III) / (V) na kovové antimon:
2 Sb3 + + 3 Fe → 2 Sb + 3 Fe2 +
Látka, která má být zkoušena na antimon, se umístí do roztoku kyseliny chlorovodíkové a smísí se se železným práškem. Výsledkem je černá, šupinatá sraženina kovového antimonu v roztoku nebo přímo na železe. Je také možné prokázat železný hřebík. Zde je černý nános na hřebu důkazem antimonu, který zde uložil elementárně.
Vzorek Marsh umožňuje jasnou detekci antimonu. Pokud se pyrolyticky deponovaná látka (tmavě lesklé zrcadlo) nerozpouští v amoniakálním peroxidu vodíku, jsou arzen a germanium vyloučeny jako možné alternativy.
Vysoce citlivé stanovení drobných stop antimonu nastává hydridovou technikou atomové spektrometrie. Vzorek Marsh je v zásadě spojen s atomovou absorpční spektrometrií. Matriční účinky roztoku vzorku lze velmi účinně potlačit.
Dalším způsobem je ošetření vodného roztoku obsahujícího antimonové ionty roztokem rhodaminu B. Tvoří barevný komplex, který lze extrahovat isopropyletherem. Tento důkaz je však zcela nespecifický, protože zlato, kadmium, gallium, thallium, uran a wolframové ionty tvoří barevné komplexy.
Připojení
- Vodíkový antimon, také nazývaný monostiban SbH3.
- Jedovatý plyn, který se tvoří z antimonu a kyselin.
- Distiban (Sb2H4)
halogenové sloučeniny
- Fluorid antimonitý (SbF5) tvoří (podle VSEPR) čtvercovou pyramidu a hybridizuje s sp3d
- Chlorid antimonitý (SbCl5)
- Fluorid antimonitý (SbF3)
- Chlorid antimonitý (SbCl3)
- Bromid antimonu (SbBr3)
- Jodid antimonitý (SbI3)
kyslíkaté sloučeniny
- Oxid antimonitý (oxid antimonitý, Sb2O3)
- Oxid antimonitý (III, V) (oxid antimonitý, Sb2O4)
- Oxid antimonu (pentaoxid antimonu, Sb2O5)
- Kyselina antimonová / trihydroxid antimonitý (H3SbO3 / Sb (OH) 3)
- Kyselina antimonová / kyselina antimonitá (III), SbOOH nebo HSbO2
- Kyselina antimonová (HSb (OH) 6)
sloučeniny síry
- Trisulfid antimonitý, nazývaný také lesk antimonu (Sb2S3)
Šedě černé lesklé kovové stonky. Výchozí materiál pro výrobu kovového antimonu. Rozpustný v silných kyselinách. Používá se pro zápalky, třecí brýle a maskovací barvy (odraz infračerveného světla). - Pentasulfid antimonu, dříve známý jako síra zlata (Sb2S5)
Ostatní sloučeniny
- Fluorid antimonitý (V) chlorid (SbCl4F) (katalyzátor pro výrobu polytetrafluorethylenu ("teflon"))
- Hliníkový antimonid (AlSb)
- Gallium antimonide (GaSb)
- Antimonid india (InSb)
Graf antimonu 2005–2020
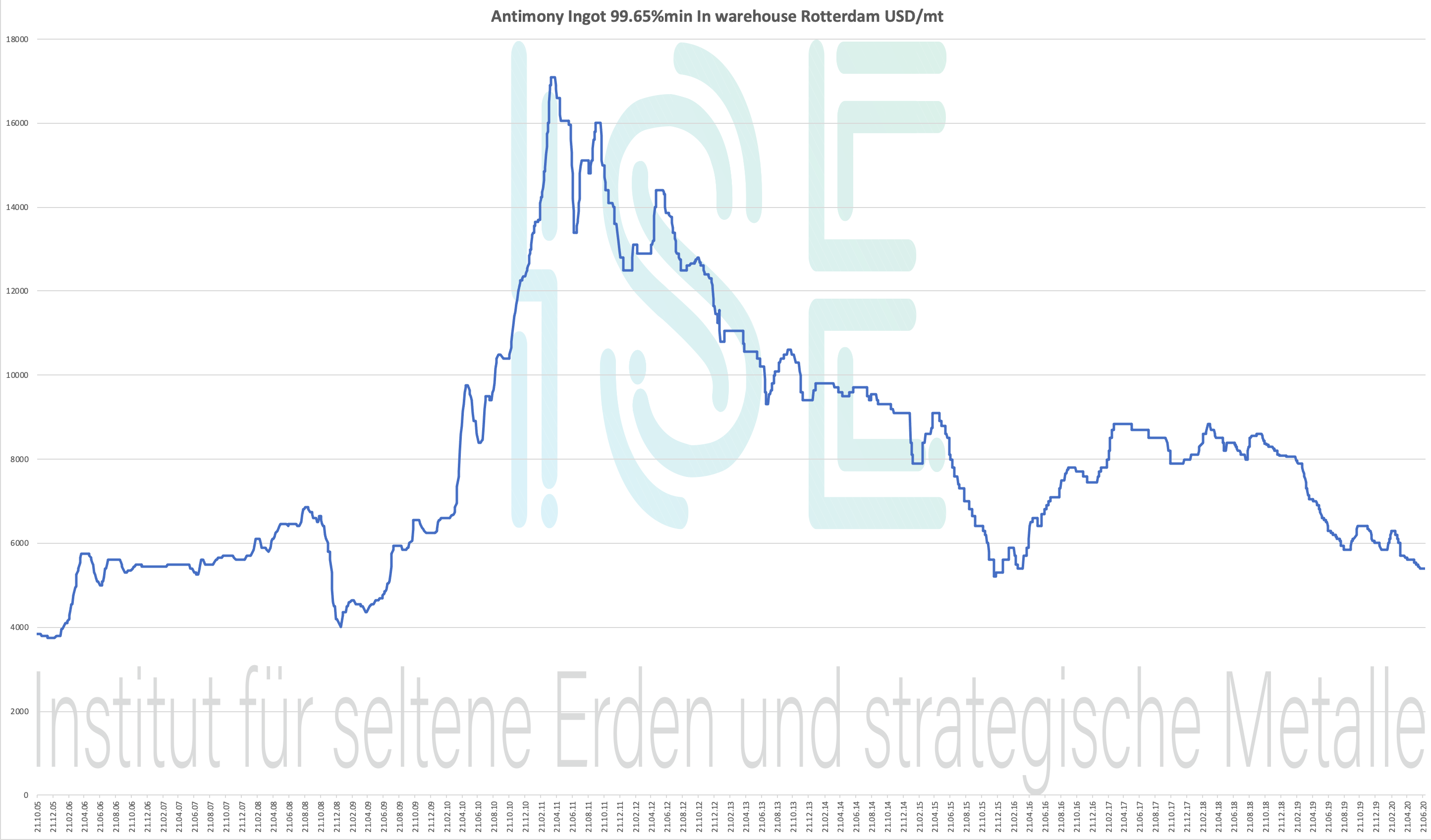
Antimony Ingot 99.65% min. Ve skladu Rotterdam USD / mt
Cenový graf 2004-2020 - pro zvětšení klikněte
Cena antimonu - pod cenou strategických kovů
Historické cenové údaje pro Antimony Ingot 99,65% sklad Rotterdam USD / mt



