Lanthanum, La, atomové číslo 57
obecný
Lanthanum [lantaːn] je chemický prvek se symbolem prvku La a atomovým číslem 57. Patří k přechodným kovům i kovům vzácných zemin, v periodické tabulce je to v 6u. Období a 3. Podskupina (skupina 3) nebo skandiová skupina. Většinou se také počítá do Lanthanoidenu, i když je f-shell prvku neobsazený.
Lanthanum (řecký λανθάνειν, lanthanein, „být skrytý“) 1839 objevil švédský chemik a chirurg Carl Gustav Mosander. Z údajně čistého dusičnanu ceru zvítězil frakční krystalizací síranu lanthanitého.
Lanthanum se přirozeně vyskytuje pouze v chemických sloučeninách spojených s jinými lantanoidy v různých minerálech. Jedná se zejména o:
Monazit ((Ce, La, Th, Nd, Y) PO4)
Bastnäsit ((Ce, La, Y) CO3F)
zotavení
Po komplexní separaci dalšího společníka lanthanidu oxid reaguje s fluorovodíkem na fluorid lanthanitý. Následně se redukuje na lanthan s vápníkem za vzniku fluoridu vápenatého. Oddělení zbývajících zbytků vápníku a nečistot se provádí dalším přetavením ve vakuu.
Funkce
Stříbřitý bílý kov je poddajný a tažný. Existují tři kovové modifikace.
Lanthanum je nedůstojné. Rychle se potáhne vrstvou bílého oxidu ve vzduchu, která ve vlhkém vzduchu reaguje na hydroxid.
Při teplotách nad 440 ° C hoří lantan na oxid lantanu (La2O3). Tvorba vodíku ve studené vodě je pomalá, v teplé vodě rychlá reakce na hydroxid. Ve zředěných kyselinách se lanthan rozpouští při vývoji vodíku. S mnoha prvky reaguje přímo v žáru, s halogeny i při pokojové teplotě. Lanthan a vodík tvoří černý, na vodu citlivý nestechiometrický hydrid.
Verwendung
Lanthanum je složka z kovového kovu. Pyroforické pazourkové materiály obsahují hmotnostní procenta lantanu 25 až 45. Kromě toho najde uplatnění jako redukční činidlo v metalurgii. Jako přídavek litiny podporuje tvorbu sféroidního grafitu, jakožto legující přísady zlepšuje odolnost proti oxidaci. Lanthanové přísady snižují tvrdost a teplotní citlivost molybdenu.
Kvalitní katody pro generování volných elektronů sestávají z hexaboridu lantanitého jako náhrady za wolframový drát. Oxid lanthanitý o vysoké čistotě se používá ve sklářském průmyslu k výrobě vysoce kvalitních skel s vysokým indexem lomu pro optiku z. B. používá se pro objektivy fotoaparátu.
S kobaltem:
Slitina kobaltu a lanthanu LaCo5 se používá jako magnetický materiál, titaničitan barnatý dotovaný lanthanem pro výrobu termistoru PTC (rezistory závislé na teplotě). Ve spojení s kobaltem, železem, manganem, stronciem a dalšími slouží jako katoda pro vysokoteplotní palivové články (SOFC). „Kontaminovaný“ nikl lanthanu (LaNi5) se používá jako zásobník vodíku v bateriích na bázi hydridu niklu a kovu. Kromě toho se dodává v uhlíkových obloukových lampách pro studiové osvětlení a ve filmových projekčních systémech (historické použití?) Dříve.
S titanem:
Slitina kovu s materiálovým složením lantanu a titanu, je účinek přičítán skutečnosti, že při zpracování tvářením je délka štěpky snížena. To by mělo usnadnit zpracování kovu.
V oblasti medicíny se z legujícího kovu vyrábějí nástroje odolné vůči korozi a snadno sterilizovatelné. Tato kovová slitina na bázi titanu je považována za zvláště vhodnou pro chirurgické nástroje a přístroje, protože alergický sklon použití takové kovové slitiny s titanem ve srovnání s jinými slitinami by měl být nízký.
Jako oxid lanthanitý
Výroba brýlí (Lanthanglas) s poměrně vysokým indexem lomu, který se zase mění jen nepatrně s vlnovou délkou (nízká disperze), pro fotoaparáty, dalekohledy a brýlové čočky
Výroba křišťálového skla a porcelánových skvrn. Nahrazuje toxičtější olovnaté sloučeniny současným zlepšením chemické odolnosti (zlepšení odolnosti vůči alkáliím, „vhodné do myčky“)
Přidání katalyzátoru do zeolitů během fluidního katalytického krakování v ropné rafinérii
Výroba keramických kondenzátorových hmot a bez silikátů
Součást leštičů skla
Výroba horkých katod pro elektronové trubice (také boridy lanthanu)
Jako uhličitan lantanitý
Lék na snížení hladiny fosfátů u dialyzovaných pacientů (tzv. Fosfátové pojivo)
Lanthanum je klasifikován jako látka s nízkou toxicitou. Toxická dávka není známa. Prášek lantanu se však považuje za vysoce korozivní, protože velmi snadno reaguje, například vlhkostí pokožky, se zásaditým hydroxidem lanthanitého (podobně jako prvky vápník a stroncium). Letální dávka u potkanů je 720 mg.
| Obvykle | |
| Jméno, symbolVlastní číslo | Lanthanum, La, 57 |
| Serie | Přechodné kovy |
| Skupina, období, blok | 3, 6, d |
| vzhled | stříbřitě bílá |
| číslo CAS | 7439-91-0 |
| Hmotnostní zlomek zemské obálky | 17 ppm |
| jaderný | |
| atomová hmotnost | 138,9055 u |
| poloměr atomu | 195 pm |
| Kovalentní poloměr | 207 pm |
| Elektronenkonf. | [Xe] 5d (1) 6s2 |
| 1. ionizace | 538,1 KJ / mol |
| 2. ionizace | 1067 KJ / mol |
| 3. ionizace | 1850 KJ / mol |
| fyzicky | |
| fyzický stav | fest |
| krystalová struktura | šestihranný |
| hustota | 6,17 g / cm3 (20 ° C) |
| magnetismus | paramagnetický (χm = 5,4 * 10 (-5)) |
| bod tání | 1193 K (920 C) |
| bod varu | 3743 K (3470 C) |
| Molární objem | 22,39 * 10 (-6) m (3) / mol |
| Výparné teplo | 400 KJ / mol |
| skupenské teplo tání | 6,2 KJ / mol |
| Elektrická vodivost | 1,626 * 10 (6) A / (V * m) |
| tepelná vodivost | 13 W / (m * K) |
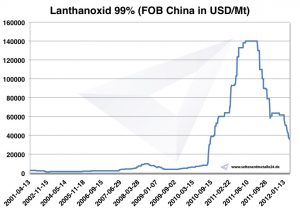
Cena lanthanu