Nikl, Ni, atomové číslo 28
Cena, výskyt, těžba a použití niklu
Nikl je chemický prvek se symbolem Ni a atomovým číslem 28. Patří k přechodným kovům, v periodické tabulce stojí po starší metodě počítání v 8u. Podskupina nebo železo-platinová skupina, podle novějších ve skupině 10 nebo niklové skupiny.
Historie
Nickel byl nejprve reprezentován čistě Axel Frederic Cronstedt 1751 a pojmenoval podle minerálu cupronickel (švédský kopparnickel, dnes Nickelin), ve kterém našel dosud neznámý kov.
Středověcí horníci používali termín cupronickel se odkazovat na rudu, která vypadala jako měděná ruda, ale od kterého žádná měď nemohla být získávána, jako by očarovaný horskými duchy (“nikl”). Podobné kobold-jako etymologie lze nalézt v kobalt.
První mince z čistého niklu byla razena 1881.
výskyt
Nikl se vyskytuje v zemské kůře s obsahem asi 0,008%. Geofyzikální a geochemické důkazy naznačují, že většina niklu se nachází na Zemi a dalších pozemských planetách v jádru, kde tvoří slitinu se železem a některými světelnými prvky. V jádru Země je jeho hmotnostní zlomek podle nejnovějších modelů asi 5,2%.
Pevný, to je v elementární formě, nikl je vzácný. Doposud bylo dokumentováno pouze umístění 50 pro pevný nikl (2018), včetně Austrálie, Číny, Kanady, Ruska a Spojených států amerických.
Tradičně je většina výroby niklu ze sulfidických rud, jako je pentlandit (asi 34% nikl), nikl magnetický štěrk (pyrrhotit a pentanditový aglomerát) a některé další minerály niklu, jako je millerit (asi 64-65% nikl) a niklin (asi 44%) Nickel) vyhrál. Kromě toho se jako suroviny pro výrobu niklu těží lateritické niklové rudy, převážně z Garnieritu, směs Népouitu (asi 46% niklu) a Willemseitu (asi 29% niklu). Celkově jsou některé minerály niklu 200 dosud známy a některé mají mnohem vyšší obsah niklu než ty, které již byly zmíněny, ale jsou mnohem méně běžné. Například velmi vzácný bunsenit je minerál s nejvyšším obsahem niklu až do 78,58%. Stejně vzácné minerály Heazlewoodite a Awaruit obsahují mezi 72 a 73% nikl.
Těžba se přesouvá díky využívání klasických sulfidických ložisek stále více na lateritické niklové rudy. Musí však být pracně získány vysokotlakým loužením kyseliny (anglické vysokotlaké loužení kyseliny).
Aby bylo možné nikl ekonomicky degradovat, musí být obsah niklu v rudě alespoň 0,5%. Nejvýznamnější události jsou v Kanadě (Sudbury Basin), Nové Kaledonii, Rusku (Norilsk a poloostrov Kola), Austrálii (Queensland) a na Kubě (Moa Bay a Nicaro). Běžným společníkem niklu je kobalt.
Nikl jako minerál

Přirozeně se vyskytující nikl ve své elementární formě byl poprvé popsán Paulem Ramdohrem 1967em a uznáván Mezinárodní mineralogickou asociací (IMA) jako nezávislý minerální druh (vnitřní vstupní číslo IMA: 1966-039).
Podle klasifikace minerálů podle Strunze (vydání 9) nikl v systému č. 1.AA.05 (prvky - kovy a intermetalické sloučeniny - měď Cupalite Family - Copper Group), respektive v zastaralém 8. Vydání uvedené pod I / A.04b (řada niklu). Klasifikace minerálů podle Dany, která se používá převážně v anglicky mluvících zemích, vede prvek minerál pod systém č. 01.01.11.05 (železo-niklová skupina).
Druhem lokality je poloostrov Bogota poblíž Canaly v severní provincii Nová Kaledonie, kde byl nalezen nativní nikl ve formě idiomorfních kubických zrn nebo vyrostlých kostek do 0,1 mm jako inkluze v Heazlewoodite a jako „spidery“ nepravidelná hmota mezi Heazlewooditkörnern. Doprovázejícími minerály kromě Heazlewooditu jsou chalkopyrit, chalcocit, galena, Godlevskit, pevná měď, millerit, orcelit, pentlandit, pyrit a pyrrhotit.
Extrakce a prezentace
Většina niklu pochází z železných rud obsahujících nikl a měď, jako je magnetický štěrk niklu. Aby byla extrakce ekonomicky výhodná, musí být nikl nejprve obohacen flotací na asi pět procent obsahu niklu. Poté se ruda peče podobně jako výroba mědi. Zde se ruda nejprve praží, aby se část sulfidu železa přeměnila na oxid železa. Následně se ke strusce oxidu železa jako křemičitanu železa přidají křemičitany a koks. Současně se surový kámen měď-nikl vytváří z niklu, mědi a sulfidu železa. Protože je to těžší než struska z křemičitanu železitého, lze obě fáze poklepat samostatně.
Následně se surový kámen naplní do konvertoru a přidá se oxid křemičitý. Vstřikuje se kyslíkem. Výsledkem je, že zbývající sirník železa se praží na oxid železa a pak se vyprává. Výsledkem je jemný kámen měď-nikl, který se skládá z asi 80% mědi a niklu a asi 20% síry.
| Hodnost | Přistát | Výroba (v milionech t) |
|---|---|---|
| 1 | Indonésie | 400.000 |
| 2 | Filipíny | 230.000 |
| 3 | Neukaledonien | 210.000 |
| 4 | Kanada | 210.000 |
| 5 | Australský | 190.000 |
| 6 | Rusko | 180.000 |
| 7 | Brazílie | 140.000 |
| 8 | Čínská lidová republika | 98.000 |
| 9 | Guatemala | 68.000 |
| 10 | Kuba | 51.000 |
Těžba Rohnickel
Aby bylo možné získat Rohnickely, musí být nikl oddělen od mědi. Za tímto účelem je jemný kámen fúzován se sulfidem sodným Na2S. Mezi mědí a sulfidem sodným se tvoří jen mírně tající dvojitý sulfid. Vytvoří se dvě snadno oddělitelné fáze dvojitého sulfidu měď-sodný (kapalina) a sulfidu niklu. Po oddělení se sirník niklu praží na oxid niklu a potom se redukuje na nikl s koksem.
Pro získání čistého niklu je Rohnickel rafinován elektrolýzou. Pro tento účel je Rohnickel připojen jako anoda, niklelfeinblech jako katoda v elektrolytickém článku. Použitý elektrolyt je roztok soli niklu. Během elektrolýzy přechází nikl a všechny méně ušlechtilé složky do anody. Všechny vznešené komponenty zůstávají pevné a spadají pod elektrodu jako anodový kal. To slouží jako důležitý zdroj pro výrobu drahých kovů, jako je zlato nebo platina. Na katodě jsou niklové ionty z roztoku redukovány na nikl, všechny méně ušlechtilé složky zůstávají v roztoku. Čistota elektrolytického niklu je kolem 99,9%.
Pro extrakci čistého niklu o čistotě 99,99% existuje speciální proces, který se nazývá podle Ludwiga Moona, který objevil tetrakarbonyl niklu 1890. Tento proces je založen na tvorbě a rozkladu tetrakarbonylu niklu. Za tímto účelem se jemně rozmělněný prášek Rohnickel uvede do proudu oxidu uhelnatého při teplotě 80 ° C. Tím se vytvoří plynný tetrakarbonyl niklu. To je zbaveno kouřového prachu a posíláno do horké dekompoziční komory 180 ° C. Uvnitř jsou malé niklové koule. V tomto okamžiku se tetrakarbonyl niklu znovu rozloží na nikl a oxid uhelnatý. Výsledkem je velmi čistý nikl.
reprezentace práce
Existují různé metody reprezentace malého množství velmi čistého niklu v laboratoři:
Redukce oxidu vodíkem při 150 ° C na 250 ° C:
Redukce suspenze chloridu nikelnatého v diethyletheru pomocí Grignardovy reakce
Tepelný rozklad oxalátu nikelnatého v nepřítomnosti kyslíku:
Redukce chloridu nikelnatého disperzí sodíku:
Zejména termolýza oxalátu poskytuje jemně rozptýlený pyroforický niklový prášek.
Eigenschaften
Fyzikální vlastnosti
Nikl je stříbřitě bílý kov, který je jedním z těžkých kovů s hustotou 8,91 g / cm3. Je středně tvrdá (Mohsova tvrdost 3,8), kujná, tažná a velmi dobře leštěná. Nikl, stejně jako železo a kobalt, je feromagnetický a má Curieovu teplotu 354 ° C. Kov krystalizuje v krystalové struktuře zaměřené na kubickou plochu (měděný typ) ve skupině prostorů Fm3m (číslo skupiny prostorů 225) s parametrem mřížky a = 352,4 pm a čtyřmi jednotkami vzorce na jednotku buňky. Tato struktura si ji zachovává i při vysokých tlacích až do alespoň 70 GPa. Další metastabilní modifikaci s kubickým tělem soustředěným kulovým obalem lze získat v tenkých vrstvách na arzenidu železa nebo gallia. Má výrazně nižší teplotu Curie s 183 ° C.
Pevnost v tahu žíhaného niklu v 400-450 MPa je při prodloužení při přetržení mezi 30 a 45%. Hodnoty tvrdosti jsou kolem 80 HB. Nikl vyztužený za studena, jehož prodloužení při přetržení je pod 2%, dosahuje pevnosti až do 750 MPa s hodnotami tvrdosti kolem 180 HB. Čisté niklové polotovary s obsahem 99% Ni lze posílit za studena.
Izotop 62Ni má nejvyšší vazebnou energii na nukleon ze všech izotopů všech prvků.
Chemické vlastnosti
Nikl je při pokojové teplotě velmi stabilní vůči vzduchu, vodě, kyselině chlorovodíkové a zásadám. Zředěné kyseliny napadají nikl jen velmi pomalu. Ve srovnání s koncentrovanými oxidujícími kyselinami (kyselina dusičná) dochází k pasivaci analogicky jako u nerezové oceli. Nikl je rozpustný ve zředěné kyselině dusičné (asi 10 až 15 procent). Dokonce i polokoncentrovaná kyselina dusičná (asi 30 procent) způsobuje znatelnou pasivaci. Nejběžnějším oxidačním stavem je + II, vzácněji jsou pozorovány -I, 0, + I, + III a + IV. V tetra-karbonyl niklu má nikl oxidační číslo 0. Soli niklu (II) se rozpustí ve vodě za vzniku aqua komplexů zelenkavé barvy.
Jemně rozptýlený nikl reaguje s oxidem uhelnatým při teplotě 50 až 80 ° C za vzniku tetrakarbonylu niklu, Ni (CO) 4, bezbarvé, velmi toxické kapaliny. To slouží jako meziprodukt pro výrobu čistého niklu procesem Měsíce. Při teplotě 180 až 200 ° C se tetrakarbonyl niklu rozkládá zpět na nikl a oxid uhelnatý.
fyziologie
Kontroverzní podstata niklu je v kontrastu s existencí několika enzymů, které obvykle obsahují nikl, ale nejsou na něm závislé, protože jeho roli jako kationtu mohou převzít jiné dvojmocné kationty. U lidí se jedná o tři proteiny, o nichž je známo, že vážou nikl:
alfa-fetoprotein váže nikl, ale nezávisí na něm, protože neexistuje žádný enzym
Acireducton dioxygenáza, enzym metioninové záchranné cesty, která typicky váže nikl nebo jiný dvojmocný kation
Polyribonukleotid 5'-hydroxyl kináza Clp1, která vyžaduje jako kofaktor hořčík, mangan nebo nikl
U rostlin a různých mikroorganismů je nezbytnost niklu způsobena izolací několika enzymů (např. Ureázy, Co-F430) obsahujících nikl v aktivním centru, jakož i detekcí nedostatků v prostředích chudých na nikl, které jsou zvýšeny přidáním Ni (II) ) Soli, zajištěné.
V elektrofyziologii se niklové ionty používají k blokování napěťově aktivovaných vápníkových kanálů.
Zdravotní problémy
Nikl je nejčastější příčinou kontaktní alergie na niklovou dermatitidu: v Německu je odhadováno, že 1,9 až 4,5 milionů lidí je na nikl senzibilizováno. Z tohoto důvodu jsou kovy a slitiny, které přicházejí do styku s kůží, stále méně pokovovány niklem. Asi 10% všech dětí je senzibilizovaných na nikl. Po obnovení kontaktu s alergenem mohou reagovat s kontaktní alergií.
Podle Evropského úřadu pro bezpečnost potravin (EFSA) je přijatelný denní příjem (TDI) niklu 2,8 mikrogramů (0.0028 miligramů) na kilogram tělesné hmotnosti. 2019 nechal Horní Rakouskou komoru práce prozkoumat dvanáct různých sójových nápojů v Agentuře pro zdraví a bezpečnost potravin. Hodnoty byly mezi 0,25 (příroda sójového nápoje Dennree) a 0,69 miligramy na litr (ano, samozřejmě, sójový nápoj organický). U sójového mléka s nejvyšší kalorií spotřeboval kilogram těžkých dětí 30 více než dvakrát tolik niklu ve čtvrtlitrovém litru, jak doporučuje EFSA.
Inhalace anorganických sloučenin niklu je spojena se zvýšeným rizikem rakoviny u spinocelulárního karcinomu plic a horních cest dýchacích. Tyto zhoubné novotvary jsou v Německu uznávány jako nemoci z povolání při pracovní expozici (BK 4109). Zvýšený obsah niklu ve vzduchu a pitné vodě je navíc rizikovým faktorem pro senzibilizaci niklu u dětí.
Použití niklu ve spotřebním zboží (jako jsou náramkové hodinky, hračky, vybavení pro zpracování potravin atd.) Je v Evropské unii omezeno nařízením, které bylo v Německu zavedeno nařízením o spotřebním zboží, které stanoví mezní hodnoty pro uvolnění.
Verwendung
Nikl je potřebný jako kov v malém množství, většina výroby jde do výroby nerezových ocelí a slitin niklu. Nikl se používá v mnoha konkrétních a identifikovatelných průmyslových a spotřebních statcích, včetně nerezové oceli, magnetů Alnico, mincí, dobíjecích baterií, strun na elektrickou kytaru, mikrofonních kapslí, pokovování na vodovodní armatury a speciálních slitin, jako je Permalloy, Elinvar a Invar. Používá se pro povlakování a jako odstín ve skle. Zásoby niklů vyčerpaných z dnešního pohledu leží mezi 70 a 170 milionů tun. V současné době se na celém světě každoročně vyprodukuje více než jeden milion tun (2006: 1,340 milionů tun). Cena niklu občas podléhá velmi vysokým cenovým výkyvům v důsledku spekulací na finančním trhu.
Přibližně 25 procenta světového niklu se nachází v Nové Kaledonii, francouzském zámořském území.

Nikl kadmiové baterie, obrázek Wikipedia
Použití jako kov
Čistý niklový kov se používá v jemně rozdělené formě jako katalyzátor při hydrogenaci nenasycených mastných kyselin. Díky své chemické odolnosti se nikl používá pro přístroje v chemické laboratoři a chemickém průmyslu (např. Kelímky na nikl pro trávení). Z niklových slitin niklu z. Pro mince.

Niklový drát (drát), niklový drát lze vytáhnout až do tloušťky 0,01mm
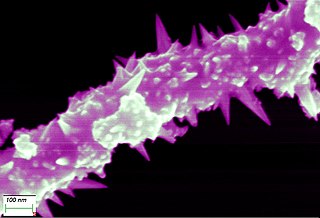
Niklový drát 0,01mm v úvahu vysoce výkonným mikroskopem
Nikl slouží jako povlakovací kov pro protikorozní ochranu ("pokovování niklem") kovových předmětů: Kvůli svým oxidačně-ochranným vlastnostem jsou kovy (zejména železo) pro určité technické účely potaženy galvanickou technologií.
Kov byl také používán dříve k výrobě rámů z niklových brýlí.
Jako beta emitor je niklový izotop 63Ni používán v detektorech elektronového zachycení v plynových chromatografech.
Použití jako slitina
Nikl je důležitý legovaný kov, který se používá hlavně k dokončování oceli. Většina niklu jde tam. Díky ní je ocel odolná proti korozi a zvyšuje se její tvrdost, houževnatost a tažnost. Ocele vysoce legované niklem se používají ve zvláště korozivním prostředí. Nerezová ocel V2A (název pochází z „testovací dávky 2 austenitické“ v ocelárnách Krupp, odpovídá X12CrNi18-8) obsahuje 8% niklu kromě 18% chrómu, V4A (obchodní značky Cromargan nebo Nirosta) 11% kromě 18% chrómu a 2% molybdenu.

Nickel coinsfotografie Wikipedia
Nikl je vynikající legovací prostředek pro určité drahé kovy a používá se při zkoušce ohněm jako sběratel prvků skupiny platiny. Nikl jako takový je schopen plně shromažďovat všech šest prvků skupiny platiny, zejména platiny a palladia, z rud a částečně sbírat zlato.
Niklová pěna nebo niklová síťovina se používá v plynových difúzních elektrodách pro alkalické palivové články.
Nikl a jeho slitiny se často používají jako katalyzátory hydrogenačních reakcí. Raney nikl, jemně rozdělená slitina niklu a hliníku, je běžnou formou, ačkoli se také používají příbuzné katalyzátory, včetně katalyzátorů typu Raney.
Asi 20% niklu se používá (v Německu) k výrobě jiných slitin niklu:
Konstantan, slitina 55% mědi a 45% niklu, která má přibližně konstantní elektrický odpor v širokém teplotním rozsahu. Používá se hlavně pro přesné odpory.
Niklové superslitiny jsou slitiny určené zejména pro použití při vysokých teplotách a v korozivním prostředí. Používají se například v leteckých turbínách a plynových turbínách elektráren.
Raney nikl, slitina niklu a hliníku, která je důležitým katalyzátorem pro hydrogenaci organických sloučenin.
Niklové stříbro, slitina mědi, niklu a zinku s obsahem niklu 10-26%, který je obzvláště odolný vůči korozi a používá se hlavně pro příbory a elektrotechnická zařízení.
Monel, také slitina mědi a niklu s asi 65% niklu, 33% mědi a 2% železa, která se vyznačuje zvláštní chemickou odolností, včetně fluoru. Používá se proto pro plynové lahve s fluorem.
Austenitická tvárná litina, speciální sferoidální litina s obsahem niklu až 20%, pro použití v korozivním prostředí a při vysokých teplotách.
důkaz
Detekční reakce solí niklu (II), které jsou obvykle rozpustné ve vodě se zelenou barvou, se provádí gravimetricky a kvalitativně v kvantitativní separaci roztokem dimethylglyoxímu (Tschugajewovo činidlo). Soli niklu se dříve volitelně vysráží sirníkem amonným jako šedo-černý sulfid niklu (II) a rozpustí se v kyselině dusičné. Specifická detekce je pak možná reakcí s dimethylglyoximem v roztoku amoniaku. Malinový červený bis (dimethylglyoximato) nikl (II) se vysráží jako komplex:
Protože se nikl kvantitativně vysráží z roztoku amoniaku dimethylglyoxímem, je tato detekce užitečná také pro kvantitativní gravimetrickou analýzu niklu. Z roztoku amoniaku lze kvantitativní stanovení také provést elektrogravimetrií na elektrodě z platinové sítě. Podobně jako jiné těžké kovy je dnes nikl obvykle kvantitativně stanoven atomovou spektroskopií nebo hmotnostní spektrometrií také v oblasti ultratrace. Mimořádně citlivá je inverzní voltametrie s adsorpční akumulací komplexu Ni-dimethyglyoxímu na zavěšených kapkách rtuti nebo rtuti.
Připojení
Nikl se vyskytuje ve sloučeninách hlavně v oxidačním stavu + II. Hladiny 0, + I, + III a + IV jsou vzácné a obvykle nestabilní. Nikl tvoří řadu většinou barevných komplexů.
oxid
Oxid niklnatý a oxid nikelnatý jsou zelené a černé pevné látky a používají se k výrobě keramiky, sklenic a elektrod. Kromě toho se používají jako katalyzátory pro hydrogenaci organických sloučenin. Oxid niklnatý (II) není, stejně jako mnoho jiných binárních oxidů kovů, stechiometrický, což znamená, že poměr nikl-kyslík se liší od 1: 1. Tato vlastnost je doprovázena změnou barvy, ve které je stechiometricky správný oxid niklu (II) zelený a nestechiometrický oxid niklu (II) je černý. Oxid nikelnatý má silný oxidační účinek a není znám jako čistá látka.
halogenidy
Chlorid nikelnatý je žlutá, vysoce hygroskopická pevná látka, která slouží jako barvivo pro keramiku a pro výrobu niklových katalyzátorů. Kromě bezvodé formy existují ještě hydridy niklu (II), z. Jako zelený hexahydrát chloridu nikelnatého, který krystalizoval z vodných roztoků chloridu nikelnatého. Chlorid bezvodého niklu (II) má strukturu trigonálních krystalů typu trigonálních krystalů typu kadmia (II) majících prostorovou skupinu R3m (číslo prostorové skupiny 166). Hexahydrát krystalizuje v monoklinickém krystalovém systému ve vesmírné skupině C2 / m (prostorová skupina č. 12).
Fluorid nikelnatý je rovněž vysoce hygroskopický a tvoří nažloutlé až zelené tetragonální krystaly. Na rozdíl od mnoha fluoridů je ve vzduchu stabilní. Krystalizuje v tetragonálním krystalovém systému s prostorovou skupinou P42 / mnm (číslo prostorové skupiny 136). Tetrahydrát krystalizuje v ortorombickém krystalovém systému s prostorovou skupinou P21ab (číslo prostorové skupiny 29, pozice 3).
Ostatní anorganické sloučeniny niklu
Hydroxid nikelnatý a hydroxid nikelnatý se používají k ukládání elektrické energie do nikl-kadmia a dalších niklových akumulátorů.
Dusičnan niklu (II) se používá v keramickém průmyslu jako hnědý pigment, při barvení jako mořidlo, pro elektrolytické pokovování niklem, pro získání oxidu nikelnatého a pro výrobu čistého niklu katalyzátoru. Dusičnan nikelnatý je silným oxidačním činidlem a obvykle se vyskytuje ve formě hexahydrátu Ni (NO3) 2 · 6 H2O.
Při pokovování (pokovování niklem) se používá síran nikelnatý a síran amonný niklnatý. Síran nikelnatý je technicky nejvýznamnější sloučenina niklu. Používá se pro výrobu dalších sloučenin niklu a katalyzátorů. Vodné roztoky síranu nikelnatého a chloridu nikelnatého se používají k elektrolytickému ukládání kovových niklových vrstev. Dále se používá při barvení jako mořidlo a při výrobě plynových masek.
Uhličitan nikelnatý se vyskytuje v několika hydrátových formách. Používá se jako katalyzátor při kalení tuků a při výrobě oxidu nikelnatého, keramických barev (pigmentů) a glazur a při galvanickém pokovování. Vytvořil trigonální krystalový systém s kosmickou skupinou R3c (číslo vesmírné skupiny 161).
Sulfid nikelnatý se vysráží z amoniakálních, ale ne kyselých roztoků obsahujících nikl se sulfidem amonným. Výsledkem je, že v procesu separace kationtů může být nikl separován se sulfidem amonným.
Nikl-antimonid je lesklý kovový minerál a má jasně měděnou červenou barvu. Nikl antimonid se používá jako materiál v deskách magnetického pole, kde se vkládá mezi magneticky citlivé vrstvy antimonidu india. Desky magnetického pole mění svůj elektrický odpor jako funkci hustoty magnetického toku a slouží jako senzor pro magnetická pole. Tvoří hexagonální krystalovou strukturu ve skupině prostorů P63 / mmc (číslo skupiny prostorů 194).
Organické sloučeniny niklu
Nikl tetrakarbonyl Ni (CO) 4 je bezbarvá, velmi toxická kapalina. Je to důležitý meziprodukt v procesu měsíce. Tetrakarbonyl niklu byl první objevenou karbonylovou sloučeninou kovu.
komplexy niklu
Nikl a zejména ionty niklu (II) tvoří mnoho, většinou barevných komplexů. Nejběžnější jsou koordinační čísla 6, 5 nebo 4. V případě slabých monodentátních ligandů, například vody, jsou obvykle přítomny jako oktaedrické a paramagnetické komplexy s vysokým spinem s koordinačním číslem 6. Silné ligandy, jako je kyanid, tvoří čtvercové planární diamagnetické komplexy s nízkým spinem. Dimethylglyoxim také tvoří čtvercový planární komplex, protože je komplex dodatečně stabilizován vodíkovými vazbami. Posledně uvedený komplex bis (dimethylglyoximato) niklu (II) je důležitý pro mokrou chemickou detekci niklu. Aniontové komplexy niklu končí na „-okoláda“.
Příklady aminových komplexů jsou modrý tetraaminový nikl (II) a fialový hexaamminový nikl (II). Obě sloučeniny se získají přidáním amoniaku do roztoků soli niklu:
Přidáním kyanidu draselného do roztoků soli niklu (II) se zpočátku vytvoří kyanid niklu (II), který se rozpustí v nadbytku kyanidu draselného na žlutý tetrakyanonitát draselný (II):
Odpovídající sloučenina se vytvoří s thiokyanátem draselným. Velmi citlivou sloučeninou je hexafluoronicát draselný (IV) (K2 [NiF6]). Tetrakyanoničitan draselný (II) může být připraven z monovalentního niklu použitím silného redukčního činidla K4 [Ni2 (CN) 6]. Kromě toho existuje celá řada komplexů s organickými ligandy, jako je ethylendiamin nebo anionty karboxylových kyselin.


![{\ displaystyle {\ ce {NiC2O4 -> [T] [] Ni + 2 CO2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4f5ac7119d30ce593cf99675097e91e39e33a04d)


![{\ displaystyle {\ ce {NiSO4 + 4NH4 + + 4OH- -> [Ni (NH3) 4] SO4 + 4H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fed711e628c3ba92046eb178a459488074a035c9)
![{\ displaystyle {\ ce {Ni (CN) 2 + 2KCN -> K2 [Ni (CN) 4]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7a2b8181f20f5d9ad99c2900689b699739283d0d)
